17 опк при менопаузе
Что такое ТТГ и о чем говорят отклонения от нормы
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для лечения щитовидки наши читатели успешно используют Монастырский чай. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
 ТТГ — тиреотропный гормон, синтезируемый гипофизом и регулирующий производство гормонов щитовидной железы Т3 и Т4. В норме такая взаимосвязь поддерживает энергетический обмен, что очень важно для правильной работы всех систем человеческого организма.
ТТГ — тиреотропный гормон, синтезируемый гипофизом и регулирующий производство гормонов щитовидной железы Т3 и Т4. В норме такая взаимосвязь поддерживает энергетический обмен, что очень важно для правильной работы всех систем человеческого организма.
Проблемы с гипофизом влияют на концентрацию трийодтиронина и тироксина в крови, веществ, чувствительных к уровню тиреотропина, вызывая нарушения в работе щитовидной железы. Гипофизарная дисфункция вызывает понижение или повышение концентрации ТТГ в крови. Высокий уровень тиреотропина приводит к развитию гипертиреоза щитовидки, пониженный уровень гормона вызывает развитие гипотиреоза.
 Что обеспечивает связь гормонов ТТГ, Т3 и Т4 в организме:
Что обеспечивает связь гормонов ТТГ, Т3 и Т4 в организме:
- энергетический обмен;
- правильное функционирование ЖКТ;
- работу сердца;
- репродуктивную функцию;
- работу ЦНС;
- белковый синтез;
- усваивание витамина А;
- нормальное состояние органов зрения и слуха.
За что отвечает гормон тиреотропин:
-
 Отвечает в первую очередь за синтез тироксина и трийодтиронина, веществ эндокринной железы;
Отвечает в первую очередь за синтез тироксина и трийодтиронина, веществ эндокринной железы; - Несет ответственность за поступление йода в клетки эндокринной железы.
- Отвечает за белковый обмен;
- Тиреотропин отвечает за синтез фосфолипидов и нуклеиновых кислот.
- Гипофизарное вещество и его норма
- Норма тиреотропина во время беременности
- На что влияет высокий и низкий уровень тиреотропина
- Лечение проблем, связанных с изменением уровня тиреотропина
Гипофизарное вещество и его норма
Норма тиреотропина определяется возрастом, полом и физическим статусом человека. Единица измерения идет в расчете на литр крови.
-
 Норма для новорожденных от 1,1 до 17 мЕд/л;
Норма для новорожденных от 1,1 до 17 мЕд/л; - Начиная с двух месяцев уровень тиреотропина должен составлять от 0,6 до 10 мЕд/л;
- Для детей с 14 месяцев норма гормона 0,4 до 6,0 мЕд/л;
- Начиная с 5 лет, показатель тиреотропина составляет от 0,4 до 5,0 мЕд/л;
- Для подростков 14 лет и взрослых норма гормона от 0,4 до 4,0 мЕд/л.
При расчете значения ТТГ эндокринологи учитывают колебания титров гормона в утреннее, дневное, вечернее и ночное время. Наиболее высок показатель тиреотропина ночью, самые низкие цифры регистрируют вечером.
Норма тиреотропина во время беременности
Щитовидная железа беременных особенно чувствительна к нарушению синтеза ТТГ. Норма гормона для беременных должна находиться в пределах до 2,5 мЕд/л. Гормональный статус меняется по мере развития плода и увеличения срока беременности. Самый низкий гормональный показатель регистрируется в первом триместре беременности. В случае многоплодия тиреотропин может быть равен нулю единиц.
Такое понижение необходимо для повышения синтеза гормонов эндокринной железы Т4 и Т3, если показатели тироксина и трийодонина, гормонов эндокринной железы, снижаются, это приводит к проблемам в развитии плода. В результате ребенок рождается с пороками развития или мертворожденным.
 Повышенный уровень ТТГ может быть вызван скачком пролактина. Высокий пролактин и ттг во время беременности, в особенности перед родами, нарушают синтез Т3 и Т4 и указывают на определенного рода проблемы, связанные с гипофизом.
Повышенный уровень ТТГ может быть вызван скачком пролактина. Высокий пролактин и ттг во время беременности, в особенности перед родами, нарушают синтез Т3 и Т4 и указывают на определенного рода проблемы, связанные с гипофизом.
 При повышении выработки тиреотропина во время вынашивания ребенка женщине выписывают синтетический левотироксин. Чтобы не допустить возникновения осложнений в период нагрузки на щитовидку необходимо проходить все обследования и сделать гемотест.
При повышении выработки тиреотропина во время вынашивания ребенка женщине выписывают синтетический левотироксин. Чтобы не допустить возникновения осложнений в период нагрузки на щитовидку необходимо проходить все обследования и сделать гемотест.
В качестве профилактического средства эндокринологи выписывают беременным препараты йода, например, Йодомарин. Препарат Йодоморин уникален по своему составу и не вызывает побочных эффектов, поэтому его рекомендуют беременным и кормящим женщинам для профилактики заболеваний щитовидки.
На что влияет высокий и низкий уровень тиреотропина
На нарушение функциональности эндокринной железы первым реагирует гормон ТТГ. Понижение уровня ТТГ в готовом результате анализа может свидетельствовать о проблеме, при развитии нарушений на эутиреоидной стадии, когда уровень гормонов щитовидки Т4 и Т3 еще в норме. Поэтому при профилактических осмотрах, гемотест на ТТГ и гормоны щитовидки обязателен.
Тест на ТТГ обязательно назначают при таких проблемах:
- депрессия;
- бесплодие;
- отсутствие месячных у женщин;
- зоб;
- нарушение сна;
- проблемы с сердечно-сосудистой системой;
- плохая кожа, прыщи.
 Детям анализ на ТТГ делают при задержке физического и умственного развития.
Детям анализ на ТТГ делают при задержке физического и умственного развития.
Симптомы повышенного ТТГ:
- высокий уровень тревожности;
- бессонница;
- постоянная усталость;
- дрожание ног и рук;
- бесплодие;
- проблемы со зрением.
Указанные выше симптомы плюс высокий уровень ТТГ указывают на такие нарушения в организме:
- заболевания ЦНС;
- проблемы с надпочечниками;
- гестоз;
- рак гипофиза;
- холецистэктомия;
- тиреоидит Хашимото.
Высокий показатель может быть вызван и ошибкой в процедуре сдачи теста. На результат влияют препараты:
- Церукал;
- Амиодарон;
- Эглонил;
- Эстрогены.
 Стресс и физические нагрузки повышают уровень гипофизарного вещества, поэтому перед сдачей крови на анализ пациент должен находиться в покое и избегать стрессовых ситуаций.
Стресс и физические нагрузки повышают уровень гипофизарного вещества, поэтому перед сдачей крови на анализ пациент должен находиться в покое и избегать стрессовых ситуаций.
Симптомы пониженного ТТГ:
- вялость;
- головная боль;
- высокая температура;
- болезненные месячные у женщин;
- отеки;
- лишний вес;
- плохая память;
- невнимательность;
- высокое давление;
- прыщи;
- непереносимость температурных условий.
 Проблемы, на которые указывает низкий титр:
Проблемы, на которые указывает низкий титр:
- онкология щитовидки;
- снижение функции гипофиза;
- передозировка гормональных препаратов при лечении эндокринной железы;
- диффузный токсический зоб;
- механическая травма гипофиза;
- проблемы с психикой;
- болезнь Пламмера.
Показатель тиреотрипина ниже нормы может указывать на чрезмерное увлечение диетами, стрессы, воспаление гипофиза.
Лечение проблем, связанных с изменением уровня тиреотропина
Если показатель выше нормы к единице измерения, это может указывать на гипертиреоз. В таком случае пациентам назначают синтетический тироксин, поддерживающий здоровое функционирование щитовидной железы.
 Высокий уровень может вызвать такое тяжелое заболевание, как рак, поэтому пациенту после получения результата анализов на тиреотропин и гормоны щитовидки назначают ряд лабораторных обследований и после этого начинают лечить.
Высокий уровень может вызвать такое тяжелое заболевание, как рак, поэтому пациенту после получения результата анализов на тиреотропин и гормоны щитовидки назначают ряд лабораторных обследований и после этого начинают лечить.
При низком уровне тиреотропина может наблюдаться эутиреоидное состояние, при котором синтез веществ, производимых эндокринной железой, в норме. Нормальным такое состояние считается только у беременных на первых двух месяцах вынашивания плода.
Если измерения уровня тиреотропина показывают низкий титр при нормальных показателях Т4 и Т3, такое состояние может указывать на тяжелые заболевания, например, инфаркт миокрада.![]()
Источник
Пик заболеваемости раком эндометрия приходится на возраст 60 лет. Поэтому гиперплазия эндометрия в постменопаузе особенно опасна: этот гиперпластический процесс служит фоном для развития злокачественной гинекологической патологии.

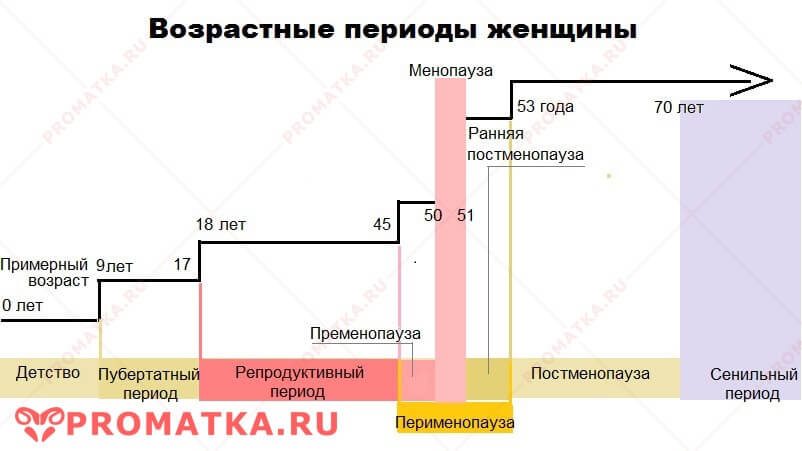
Когда наступает постменопауза
Менопауза – это время последней физиологической менструации.
Постменопауза или климакс – это возрастной период женщины после наступления стойкой менопаузы.
Примерно у 50% женщин менопауза приходится на возраст 45-50 лет, у 20% — наступает после 50 лет, у 25% наблюдается ранняя (до 45 лет) менопауза.
 Периоды развития женщины
Периоды развития женщины
О причинах и лечении гиперплазии эндометрия в менопаузе читайте подробно в статье: Гиперплазия эндометрия в менопаузе.
Вернуться к оглавлению
Что такое гиперплазия эндометрия – краткий обзор
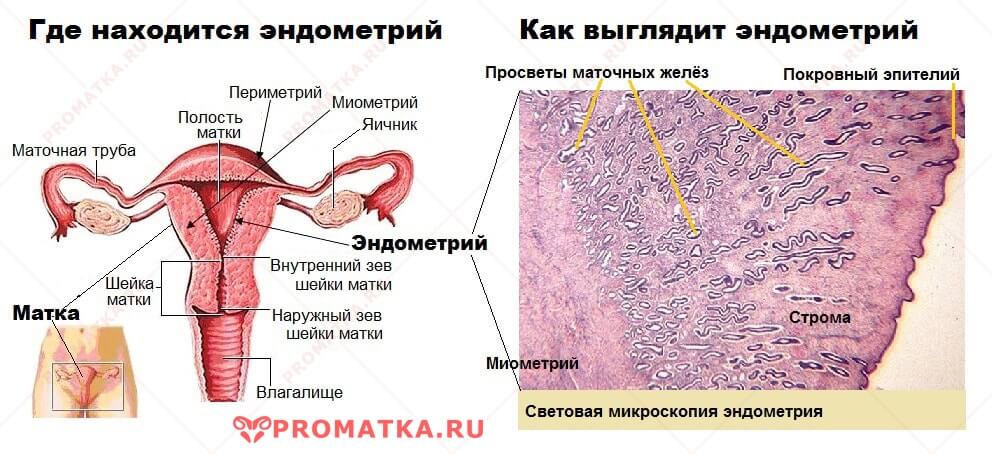
 Внутренние половые органы женщины
Внутренние половые органы женщины
Эндометрий – это внутренняя оболочка матки; точнее — слизистый слой маточной стенки, прилегающий к миометрию (мышечному слою). Он представлен стромой, погружёнными в неё маточными железами и кровеносными сосудами.
Гиперплазия эндометрия – доброкачественная гормонально-зависимая пролиферативная трансформация слизистой оболочки матки с нарушением её структуры и функций.
Эндометрий – изменчивая, высокочувствительная к действию половых гормонов ткань. Эстрогенная стимуляция способствует её росту за счёт пролиферации маточных желёз. Прогестерон, напротив, стимулирует созревание и разрастание стромы, но угнетает пролиферацию эпителия желёз.
Подробно о разных формах гиперплазии эндометрия, причинах развития и лечении этой болезни читайте в статье: Лечение гиперплазии эндометрия.
Основной объём эстрогенов и прогестерона у женщин вырабатывается в яичниках.
В детородном возрасте ключевым моментом развития типичной гиперплазии является гормональный дисбаланс, точнее — эстрогения: гиперстимуляция эндометрия эстрогенами при недостатке сдерживающей активности прогестерона.
Причины гиперплазии эндометрия в постменопаузе после угасания гормональной активности яичников не всегда объяснимы.
Ведущую роль в развитии онкологических заболеваний женских половых органов и гиперпластической патологии эндометрия в постменопаузе играет генетическая предрасположенность.
 Структура гиперпластических процессов эндометрия в постменопаузе
Структура гиперпластических процессов эндометрия в постменопаузе
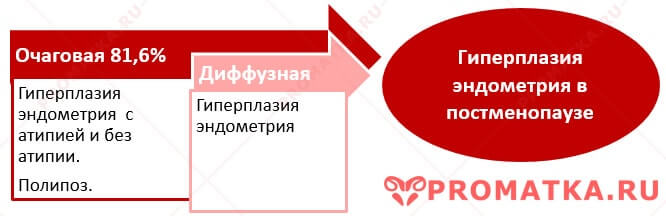
Атипическая гиперплазия эндометрия – предраковый процесс. Она может возникать самостоятельно, а также на фоне диффузной, очаговой типичной гиперплазии, полипоза и атрофии эндометрия.
О рисках, прогнозе и лечении гиперплазии эндометрия с атипией читайте подробно в статье: Атипическая гиперплазия эндометрия.
Вернуться к оглавлению
Причины диффузной гиперплазии эндометрия в постменопаузе
Появление диффузной гиперплазии слизистой матки в старшем возрасте в первую очередь заставляет искать источник патологической секреции эстрогенов.
Причины гиперэстрогении в постменопаузе:
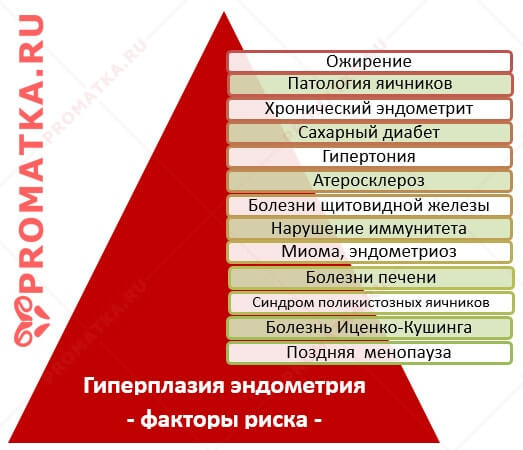
- Патология яичников: гормонально-активные опухоли яичников, текоматоз, стромальная гиперплазия яичников.
- Диэнцефальная патология: возрастная перестройка ЦНС и связанные с ней эндокринно-метаболические нарушения.
- Ожирение: внегонадная продукция эстрогенов в жировой ткани.
Причины очаговой гиперплазии эндометрия в постменопаузе
Очаговая гиперплазия слизистой матки в старшем возрасте чаще всего протекает в виде полипоза.
Полипоз – это форма очагового гиперпластического процесса, обусловленная доброкачественной трансформацией базального слоя эндометрия.
Типичная очаговая гиперплазия или полипоз эндометрия в постменопаузе развиваются на фоне хронического воспаления атрофированных участков слизистой матки (хронического атрофического эндометрита).
Местные факторы развития локальной патологии эндометрия в постменопаузе:
- Изменение гормонально-рецепторного аппарата эндометрия: увеличение количества и чувствительности эстрогеновых рецепторов к малым дозам гормона.
- Повышение активности инсулиноподобных факторов роста.
- Замедление запланированной гибели клеток (апоптоза).
- Нарушение локального иммунитета.
Факторы риска гиперплазии эндометрия в постменопаузе
 Гиперплазия эндометрия — факторы риска
Гиперплазия эндометрия — факторы риска
Вернуться к оглавлению
Симптомы гиперплазии эндометрия в постменопаузе
- Маточные кровотечения.
- Кровянистые выделения из матки.
- Иногда: гноевидные выделения из матки.
- Иногда: тянущие, схваткообразные боли внизу живота.
- Бессимптомное течение.
Диагностика
1. Ультразвуковое трансвагинальное сканирование – оптимальный метод первичной диагностики патологии эндометрия.
| Продолжительность постменопаузы | М-эхо |
| Менее 5 лет | ≤5 мм |
| Более 5 лет | ≤4 мм |
| Длительная | Плохая визуализация |
УЗИ-признаки гиперплазии эндометрия в постменопаузе:
- Увеличение М-эха >5 мм
- Неоднородность структуры эндометрия.
- Неровность, нечёткость границы между мышечным и слизистым слоями стенки матки.
- Допплерография: изменение кровотока, высокая резистентность кровотока в эндометрии.
- Серозометра: жидкость в полости матки.
2. Гистероскопия с использованием жёсткого гистероскопа в сочетании с раздельным диагностическим выскабливанием эндометрия и эндоцервикса (слизистой канала шейки матки).
3. Гистологическое исследование: изучение удалённого эндометрия под микроскопом.
4. Выявление патологии яичников: УЗИ, биопсия, МРТ (при необходимости).
5. Для определения генетической предрасположенности к гиперплазии и злокачественной трансформации эндометрия делается генетический анализ специфических ферментов ММРI, АСЕ и цитохрома 1А1 (CYP 1А1).
Вернуться к оглавлению
Лечение гиперплазии эндометрия в постменопаузе
Фракционное (раздельное) диагностическое выскабливание слизистой матки под контролем гистероскопии – первый этап лечения гиперплазии эндометрия и рекомендованный для постменопаузы способ остановки маточного кровотечения.
Выбор тактики лечения гиперплазии эндометрия в постменопаузе зависит от результатов гистологического исследования образцов эндометрия.
В старшем возрасте велик риск перерождения доброкачественной гиперплазии в рак эндометрия. Поэтому в лечении патологии эндометрия постменопаузального периода предпочтение отдаётся оперативным тактикам:
- Удаление матки с придатками.
- Аднексэктомия: удаление яичников.
- Абляция эндометрия: разрушение слизистой матки.
Абляция (аблация, резекция) эндометрия — метод щадящего хирургического лечения простой диффузной гиперплазии эндометрия в постменопаузе. Эффективность метода ≈83,4%.
Абляцию эндометрия делают:
- через несколько дней поле выскабливания и гистологического исследования эндометрия;
- в случае рецидива типичной гиперплазии эндометрия после безуспешной гормональной терапии.
В ходе абляции разрушают всю слизистую оболочку матки вместе с её базальным слоем на глубину 3-5 мм. Чаще операцию делают электрохирургическим способом.
Эта операция в некоторых случаях служит альтернативой радикальному хирургическому лечению (удалению матки) при рецидивирующей гиперплазии эндометрия.
- Типичная (простая, комплексная) гиперплазия эндометрия в сочетании с патологией яичников, миомой, эндометриозом, эндокринно-метаболическими нарушениями.
- Рецидив типичной простой (комплексной) гиперплазии эндометрия.
- Гиперплазия эндометрия с атипией.
- Аденоматозные полипы эндометрия.
Однозначный выбор лечения атипической гиперплазии эндометрия и аденоматозных полипов в постменопаузе – хирургическое удаление матки с придатками.
Консервативную гормональную терапию в указанных случаях в постменопаузе проводят только при противопоказаниях к операции.
Единственное показание к консервативному лечению патологии эндометрия в постменопаузе — простая гиперплазия эндометрия без атипии.
| Гестагены в непрерывном режиме | Дозировка | Кратность |
| 17а-ОПК | 250 — 500 мг | 2 раза в 7 дней |
| Депо-провера | 450 – 600 мг | 1 раз в 7 дней |
| Провера | 20 мг | ежедневно |
| Норколут | 10 мг | ежедневно |
Контроль эффективности лечения проводят через 6 месяцев:
- УЗИ
- аспирационная биопсия;
- повторное диагностическое выскабливание.
Рецидив типичной гиперплазии эндометрия в постменопаузе лечится оперативно.
Показания:
- Типичная очаговая гиперплазия эндометрия.
- Простой полипоз.
В постменопаузе, на фоне хронического атрофического эндометрита лечение очаговых гиперпластических процессов эндометрия гестагенами малоэффективно.
Этапы комбинированного лечения
Вместе с гистероскопией и процедурой диагностического выскабливания проводится:
- Удаление полипов.
- Избирательное прижигание (деструкция) базального слоя эндометрия в зоне удалённого полипа или очага полипоза.
- Местная противовоспалительная терапия: промывание полости матки раствором хлоргексидина 0,02%, др.
Общее антибактериально-противовоспалительное лечение:
- цефазолин + метронидазол;
- левофлоксацин,
- ципрофлоксацин,
- доксициклин,
- гентамицин,
- др.
- Актовегин — для стимуляции заживления травмированных тканей матки.
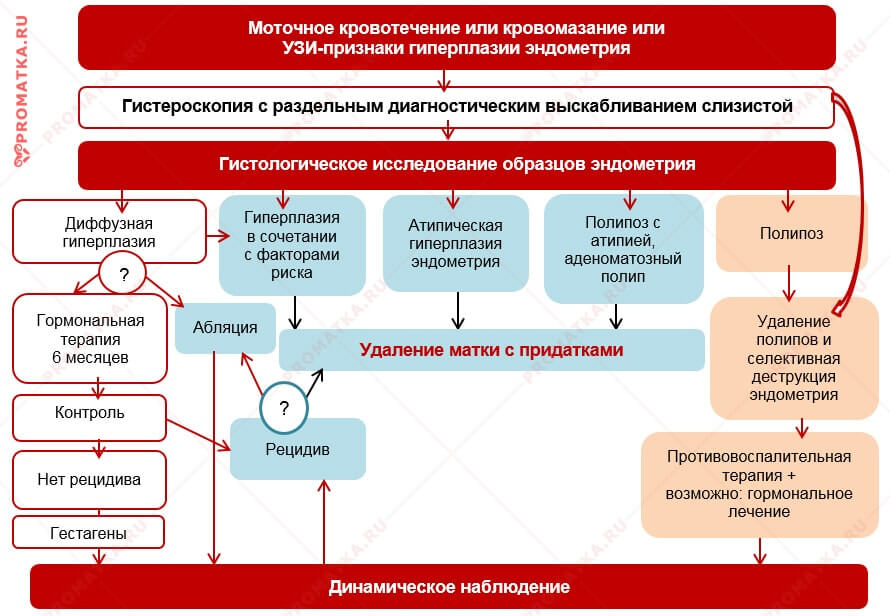 Лечение гиперплазии эндометрия в старшем возрасте
Лечение гиперплазии эндометрия в старшем возрасте
Среди гинекологических онкологических заболеваний рак эндометрия занимает второе место после рака шейки матки. Поэтому методом выбора лечения гиперплазии эндометрия у пациенток старшего возраста считается хирургическое удаление матки с придатками.
Источник
Как ранее было известно, миома матки
развивается на фоне гиперэстрогении, прогестерондефицитных состояний, гипергонадотропизма.
Большинство исследователей считают, что рост миомы зависит от концентрации цитозольных
рецепторов в половых гормонах и сложных механизмов их взаимодействия с эндогенными
или экзогенно-вводимыми гормонами. Известно, что после наступления менопаузы
происходит уменьшение размеров миоматозных узлов, однако остается спорным вопрос,
является ли это следствием уменьшения количества рецепторов или результатом
снижения уровня эстрогенов, прогестерона и андрогенов (существует гипотеза о
том, что миомы могут быть чувствительными к андрогенам).
Показания : размер
матки до 12 нед, размер миоматозных узлов до 2 см, отсутствие нарушения функции
соседних органов, умеренное проявление симптомов, интрамуральное или субсерозное
расположение узлов, отсутствие противопоказаний к применяемым препаратам, отсутствие
быстрого роста узлов.
I. Агонисты ГнРГ
Механизм действия:
синтетические агонисты гонадотропин-рилизинг-гормонов (а-ГнРГ), связываясь с
рецепторами гонадолиберина в гонадотрофах аденогипофиза, обеспечивают выраженное
угнетение секреции гонадотропинов, что способствует наступлению временной фармакологической
менопаузы и приводит к значительному уменьшению размеров матки у больных с миомой.
В последующем, по мере введения а-ГнРГ, рецепторы исчезают с поверхности клеток
гипофиза, а непрерывное введение а-ГнРГ предупреждает появление новых рецепторов
в количестве, достаточном для синтеза гонадотропинов. Таким образом, было установлено,
что непрерывное введение а-ГнРГ сначала приводит к непродолжительной стимуляции,
а затем к десенситизации и длительной блокаде секреции гонадотропинов. Известно,
что эта блокада является временной, обратимой и сопровождается аменореей.
В настоящее время синтезировано более 2 тыс.
а-ГнРГ и имеется более 12 их коммерческих типов. В нашей стране зарегистрированы
следующие а-ГнРГ: золадекс (гозерелина ацетат), декапептил (трипторелин), нафарелин
и бусерелин.
1. Золадекс (гозерелина
ацетат) выпускается в капсулах депо для подкожного введения по 3,6 мг и в капсулах
депо продленного действия по 10,8 мг. Вводится — подкожно по 3,6 мг, начиная
со 2 — 4-го дня менструального цикла, 1 инъекция каждые 28 дней в течение 4
— 6 мес.
2. Декапетил, декапептил-депо, TRIPTORELIN
— действующее вещество трипторелин -Депо-форма: разовая доза
— 3,75 мг, частота введения 1 раз в 28 дней, начиная с 3-го дня менструации.
Вводят п/к (в области живота, ягодиц или плеча) или глубоко в/м. Инъекцию делают
каждый раз в разные области. Длительность терапии не должна превышать 6 мес.
3) Нафарелин и бусерелин
используются в виде эндоназального спрея в дозе 400 — 800 мг/день.
Каждая инсуффляция содержит 200 мг нафарелина ацетата.
Большинство исследователей отмечают уменьшение
объема матки на фоне лечения а-ГнРГ в среднем на 52,6%. В настоящее время накоплен
определенный опыт использования а-ГнРГ для лечения этого заболевания. Наряду
с этим имеются сообщения, что от 5 до 18% миоматозных узлов не претерпевают
изменений на фоне проводимой терапии. Интересно, что у одной и той же пациентки
с множественной миомой матки может наблюдаться различная степень изменений размеров
каждого миоматозного узла.
Неоднозначные результаты большинство исследователей
связывают с различным соотношением в миоматозных узлах фиброзного и гладкомышечного
компонентов. Существует также мнение, что вариабельность ответа отдельных миоматозных
узлов на лечение связана с дегенеративными изменениями в опухоли и потерей чувствительности
к антиэстрогенным воздействиям. Имеются сообщения, что процент уменьшения объема
матки и миоматозных узлов зависит также от возраста пациенток и первоначального
объема матки до лечения. Другие авторы отрицают такую закономерность.
Данные литературы свидетельствуют, что наиболее
отчетливый эффект терапии а-ГнРГ наблюдается после 3 — 4 месяцу лечения с последующим
его снижением к 6 месяцу применения агонистов гонадолиберина. В отдельных случаях
после первоначального регресса размеров опухоли на 50 — 68% в течение первых
3 — 4 месяцев введения препарата продолжение терапии до 6 месяцев может привести
к вторичному увеличению миоматозных узлов на 75 — 100% от первоначального объема.
Однако при использовании а-ГнРГ может возникать
ряд побочных реакций, связанных с выреженной гипоэстрогеннией: снижение либидо,
лабильность, депрессии, приливы, незначительная деминерализация костей.
В литературе последних лет имеются публикации
о частичном восстановлении эстрогенного статуса при дополнении к постоянному
назначению агонистов гонадолиберина эстрогенов, что рассматривается как возможная
стратегия для долгосрочного лечения агонистами. Уровни эстрадиола в пределах
определенного, базального уровня уменьшают побочные эффекты и предотвращают
нарастающую резорбцию костной ткани, не вызывая при этом повторного роста миомы.
Частичного восстановления эстрогенного статуса
можно добиться комбинированным приемом небольших доз эстрогенов и прогестерона
в дополнение к агонистам (add-back-режим). Так, например, при добавлении клиогеста
уровень эстрадиола поднимается до «порогового», при котором не возобновляется
рост миомы, а частота побочных эффектов гипоэстрогении либо снижается, либо
они отсутствуют. В этом режиме, по мнению исследователей, лечение агонистами
может быть продолжено по крайней мере в течение 2 лет. Другие авторы как альтернативную
стратегию предлагают периодическое полное восстановление эндогенной продукции
эстрогенов, когда терапия а-ГнРГ проводится прерывистыми курсами, после 3 мес
приема препарата следует 3-месячный перерыв (on-off-режим). По данным литературы,
увеличение объема матки во время интервала, свободного от лечения, при таком
режиме минимально.
Следует отметить режим, в котором лечение проводится
с возрастающим интервалом между последующими дозами а-ГнРГ от 4 до 10 и 12 нед
(interval-режим), что, по мнению авторов, создает адекватное уменьшение объема
матки при снижении побочных эффектов, и при этом лечение может быть продолжено
до 2 лет.
Имеются сообщения о возможности частичного
восстановления уровня эстрогенов после начального периода лечения с достижением
выраженной гипоэстрогении (draw-back-режим). Предварительные результаты исследований
показали, что выраженный эффект высокой дозы агониста (100 мг/день) в течение
8 нед лечения сохраняется после введения более низкой дозы (от 5 до 20 мг/день)
агониста в течение 18 нед, поддерживая частичное подавление гипофиза и яичников,
что подтверждается уровнями ЛГ и эстрадиола в различных группах в зависимости
от дозы. Интересно, что комбинированное назначение прогестинов и агонистов,
по мнению ряда авторов, не приводит к уменьшению размеров матки. Более того,
имеются сообщения о том, что прогестины имеют стимулирующее влияние на рост
миомы даже при отсутствии эстрогенов.
Таким образом, исследования, выполненные к настоящему времени, свидетельствуют,
что агонисты гонадолиберина могут быть рекомендованы в качестве эффективной
предоперационной терапии, позволяющей производить более щадящие реконструктивные
операции с использованием современных новейших технологий. Наряду с этим а-ГнРГ
могут применяться как первичное медикаментозное лечение у пациенток в перименопаузе,
что в ряде случаев позволяет избежать оперативного вмешательства. Следует отметить
значение терапии агонистами гонадотропин-рилизинг-гормона у пациенток с метроррагией
и анемией, что позволяет не только восстановить основные показатели крови и
уменьшить риск хирургического лечения, но и создать банк крови для аутодонации.
Препараты хорошо переносятся, не обладают антигенными свойствами, не аккумулируются,
не влияют на липидный спектр крови. Изменения плотности костной ткани не имеют
клинического значения при длительности терапии до 6 месяцев и в большинстве
наблюдений обратимы после завершения лечения.
II. Прогестины — «чистые» гестагены.
Гестагены в современной гинекологической практике
до сих пор широко используются для лечения миомы матки, поскольку их применение
является сравнительно эффективным и дешевым методом лечения.
Механизм действия:
большие дозы прогестерона подавляют высвобождение гипофизарных гонадотропинов
и таким образом блокируется продукция эстрогенов в яичниках. Однако степень
подавления продукции эстрогенов не бывает столь значительной как при применении
агонистов ГнРГ. Высокие концентрации прогестерона, превышающие его содержание
в крови в лютеиновую фазу цикла, блокируют процессы гиперплазии и гипертрофии
биогенных элементов миомы матки и усиливают дегенеративно-дистрофические процессы
в клетках центральной части узлов опухоли. Важно помнить, что физиологические
концентрации прогестерона практически не влияют на морфофункциональное состояние
опухолевых миоцитов, которое в основном в этой ситуации определяется содержание
в крови эстрадиола. Следовательно, можно ожидать, что применение высоких доз
прогестерона или синтетических гестагенов с высокой биологической активностью
может оказать влияние на морфофункциональное состояние тканевых элементов узлов
миомы.
1) Норколут (NORETHISTERONE); прималют-нор. Выпускаются
в таблетках по 5 мг. По 1 таблетке в сутки с 5-го по 25-й день менструального
цикла в течение 3-6 месяцев. Дозу препарата следует подбирать индивидуально
в зависимости от эффективности терапии и переносимости препарата.
2) Дюфастон (дидрогестерон),
таблетки по 10 мг. Назначают препарат по 10 мг 2-3 раза/сут с 5-го по 25-й день
цикла или непрерывно. Минимальный курс — 3 мес, наибольший терапевтический эффект
наблюдается при приеме препарата в течение 6 мес.
3) 17-ОПК (17-Оксипрогестерона
капронат). Форма выпуска: 12,5% (0,125 г) и 25% (0,25 г) маслюнного раствора
в ампулах по 1 мл. 17-ОПК назначают в концентрациях 500 мг на инъекцию при двукратном
введении препарата в неделю на 3-6 месяцев. Уже к исходу 12 — 14 недели лечения
обнаруживается развитие выраженной атрофии эндометрия и уменьшение размеров
матки.
Однако надежды, возлагаемые на уменьшение или
полное рассасывание миоматозных узлов при лечении аналогами прогестерона, в
полной мере не оправдались. Более того, в некоторых случаях наблюдалось увеличение
размеров матки и миомы. Установлено, что существенную роль в возникновении и
росте миомы матки могут играть сами прогестины, поскольку в лютеиновую фазу
цикла в миомах увеличивается митотический индекс. Доказано также, что экспрессия
рецепторов и соответствующих мРНК увеличена в миомах матки по сравнению с нормальным
миометрием как для эстрогенов, так и для прогестерона.
III. Производные 17-этинил-тестостерона
Механизм действия:
препараты обладют антигонадотропным действием, блокируя овуляторный выброс гонадотропинов,
блокируют рецепторы эстрадиола, прогестерона и андрогеннов в ячниках, а также
снижают в крови уровень сексстероидсвязывающего глобулина.
Производные 17-этинил-тестостерона даназол (дановал,
данол) выпускаются в капсулах по 100 и 200 мг. Их назначают внутрь в дозе 400-800
мг в день в течении полугода.
Следует отметить, что даназол и его аналоги дастаточно редко применяются для
лечения миомы матки, однако соответсвующие схемы лечения разработаны и о них
необходимо знать.
IV. Производные 19-норстероидов
Механизм действия:
препараты обладают высокой антигонадотропной активностью и способностью блокировать
рецепторы эстрогенов и прогестерона в ткани эндометрия, что вызывает интенсивные
инволютивные изменения в эндо- и миометрии матки. Одним из представителей производных
19-норстероидов является гестринон. Лечебная доза препарата составляет 2,5 мг
два раза в неделю.
Производные 19-норстероидов крайне редко используются
для лечения миомы матки. В основном эти препараты используют для лечения эндометриоза.
V. Андрогены
Механизм действия:
вызывают торможение гонадотропной функции гипофиза, угнетение функции фолликулярного
аппарата и яичников, атрофию эндометрия, подавление функции молочных желез.
Наиболее известными представителями андрогеннов являются тестостерона пропионат
(agovirin, testoviron), тестэнат, тетрастерон ( сустанон-250, омнадрен-250
) и другие.
1) Тестостерона пропионат
1% или 5% масляный раствор в ампулах по 1 мл. Вводят внутримышечно по 5-10 мг
ежедневно или через день в течении 4-6 месяцев.
2) Тестэнат 10% раствор
в ампулах по 1 мл. Вводят внутримышечно по 1 мл 10% раствора 1 раз в 2 недели
в течении 4-6 месяцев.
3) Тетрастерон (сустанон-250,
омнадрен-250) выпускается в ампулах по 1 мл. Вводят внутримышечно по 1 мл масляного
раствора 1 раз в 4 недели в течении 6 месяцев.
В настоящее время лечение миомы матки андрогенами
не применяется в связи с новыми представлениями о патогенезе миомы, где определенную
роль в гипертрофии и гиперплазии играют андрогены и состояния, связанные с их
повышенным содержанием. Вторая причина- это возникающие в ходе лечения вирильный
синдром (гипертрихоз, огрубление голоса, увеличение клитора и т.д.).
VI. Антиандрогены
Механизм действия:
способны подавлять физиологическую активность эндогенных андрогенов путем конкурентного
блокирования рецепторов андрогенов в тканях-мишенях, таким образом препятствовать
одному из моментов возникновения гипертрофии и гиперплазии — ключевых механизмов
развития миомы матки; биосинтеза и секреции андрогенов они не нарушают.
1) Ципротерона ацетат
(Андрокур) выпускается в таблетках по 0,05 г (50 мг) в упаковке по 50 штук;
в ампулах по 3 мл, содержащего 0,3 г (300 мг) масляного раствора. Принимают
по 1 таблетке 2 раза в день или внутримышечно по 3 мл 10% масляного раствора
(Андрокур-депо) 1 раз в 10-14 дней. Курс лечения — 6 месяцев.
2) Финастерид (Проскар)
выпускается в таблетках по 0,005 г (5 мг). Принимают финастерид внутрь по 1
таблетке 1 раз в день в течении 4-6 месяцев.
Антиандрогены в практической гинекологии для
лечения миомы матки используются крайне редко из-за недостаточной эффективности.
VII. Заместительная гормональная терапия
(ЗГТ)
Заместительная гормональная терапия (ЗГТ) аналогами
женских половых гормонов является основным методом профилактики и коррекции
климактерических расстройств. ЗГТ купирует симптомы климактерического синдрома,
ослабляет симптомы, вызванные атрофией влагалища, предотвращает разрушение костной
ткани, снижает риск развития сердечно-сосудистых заболеваний и уменьшает общую
смертность женщин в постменопаузе. Однако обычной клинической дилеммой является
вопрос о том, использовать ли ЗГТ у больных с миомами, наиболее часто встречающимися
доброкачественными опухолями матки. Миома матки — одно из наиболее распространенных
заболеваний матки у женщин репродуктивного возраста, в постменопаузе ее размеры
обычно уменьшаются. Однако при назначении ЗГТ следует обращать особое внимание
на наличие у женщин миомы из-за риска ее увеличения на фоне лечения.
Согласно данным A.Senez и соавт. после одного
года ЗГТ 0,625 мг конъюгированных эстрогенов в сочетании с 2,5 мг медроксипрогестерона
ацетата достоверных изменений диаметра миоматозных узлов не наблюдалось. Однако
размеры узлов увеличились, когда доза гестагена была удвоена. По данным этих
авторов, очевидно, что рост миом в постменопаузе происходит более активно в
гормональной среде, характеризующейся высоким уровнем прогестерона, чем в присутствии
высокой концентрации эстрогенов. В нескольких статьях других авторов не отмечено
значительных изменений объема и размеров матки и миоматозных узлов при лечении
климактерических расстройств препаратами циклического режима.
Анализируя имеющиеся разноречивые данные о влиянии
циклической ЗГТ на миому матки, Я.З. Зайдиева, Ю.И. Липатенкова установили,
что эти различия зависят от фармакологических характеристик прогестагена, входящего
в состав препарата. На основании проведенных исследований влияния гормональных
препаратов, в состав которых входят различные прогестины, пациенткам с миомами
матки в климактерии предпочтительнее назначать лекарственные средства, имеющие
в своем составе прогестагены норстероидного ряда, оказывающие выраженное антипролиферативное
действие в гормонозависимых органах-мишенях. Например, Клиогест, Трисеквенс.
Источник: https://www.myoma.by.ru
Смотрите также:
У нас также читают:

