Апоптоз и миома матки
Лейомиомы определяют как доброкачественные моноклональные разрастания гладкой мышечной ткани. Каждая моноклональная миома может ассоциироваться с различными хромосомными транслокациями, дупликациями и делециями. Многие, однако не все, миомы содержат имеют цитогенетические отклонения, в то время как мышечная оболочка матки имеет нормальный кариотип — обычно они включают хромосомы 7,12 и 14. Большинство мутаций появляется в генах, отвечающих за клеточный рост или ответственных за архитектурную транскрипцию.
Выявлено два наследственных нарушения, при которых миомы матки — часть генетически обусловленного синдрома:
• Врожденный лейомиоматоз в сочетании с раком, происходящим из клеток почечного эпителия. Это аутосомно-доминантный синдром (гладкомышечные опухоли матки, кожи и почек).
• Синдром легочного лейомиоматоза и лимфангиомиоматоза. Возникает в результате мутаций в одном из двух генов, отвечающих за туберозный склероз — синдром, приводящий к развитию гамартом ы со сложной структурой.
В большинстве случаев миомы макроскопически проявляются как дискретные круглые опухоли, которые светлее, чем окружающая мышечная ткань матки, с блестящими на разрезе образованиями жемчужно-белого цвета. К особенностям тканевой структуры относится наличие переплетающихся тяжей из гладкомышечных волокон, между которыми расположена фиброзная ткань.
Влияние стероидных гормонов лежит в основе теории «клональной экспансии миомы». Миомы восприимчивы к эстрогенам и прогестерону, поэтому, скорее всего, они могут увеличиваться в размере и вызывать сопутствующую симптоматику у женщин репродуктивного возраста. С другой стороны, при наличии миом не отмечено увеличения концентрации циркулирующих эстрогенов и прогестерона в сыворотке крови.
Факторы, инициирующие развитие опухоли и еще подлежащие уточнению генетические факторы, связаны с ключевыми соматическими мутациями, способствующими развитию лейомиоцита из нормальной мышечной клетки и восприимчивыми к воздействию эстрогенов и прогестерона. Существенную роль в развитии миом имеет интегральное воздействие ЭР, ПР и рецепторов ЭФР. Как показал ряд исследований, по сравнению с нормальным миометрием в миомах отмечена повышенная концентрация рецепторов, чувствительных к эстрогенам, и ПР.

В миомах отмечен повышенный синтез ароматазы р450. В свете этого, наряду с воздействием циркулирующих эстрогенов на ЭР, большое значение в потенцировании действия эстрогенов на миоциты может иметь местная конверсия циркулирующих андрогенов в эстрогены.
Обычно считали, что эстроген — главный гормональный медиатор роста миом. Хотя прогестины применяют для лечения кровотечения при симптомной миоме, недавние исследования показывают, что прогестерон может играть значительно большую роль в качестве медиатора роста миом, чем это считали раньше. Доказано, что антипрогестин RU486 (мифепристон) вызывает уменьшение размера миом, а еще одно исследование показало, что в миомах в секреторную фазу увеличивается количество митозов по сравнению с пролиферативной фазой.
Развитие опухолевых новообразований — результат ускоренной клеточной пролиферации, опережающей тормозящий эффект апоптоза. Доказано, что апоптоз приостанавливается в миомах матки. Воздействие прогестерона повышает количество противодействующего апоптозу белка bcl-2, поэтому стимуляция роста миомы может быть результатом подавления апоптоза прогестероном. In vitro было отмечено, что при добавлении прогестерона к культуре клеток лейомиомы увеличивался синтез bcl-2 по сравнению с контрольными наблюдениями. В нормальном миометрии чрезмерного образования bcl-2 в присутствии прогестерона не отмечено.
В целом на процесс апоптоза влияет не только семейство bcl-2, но также соотношение Fas/FasL и Rb-1. Martel и соавт. описали различные механизмы развития апоптоза, недостаточно выраженные в лейомиомах, и наметили возможные «мишени» для терапии миом. Роль апоптоза в патогенезе миом — перспективная область будущих исследований с огромным потенциалом для применения в медицинской практике.
Кроме того, в патофизиологии роста миом было обнаружено синергичное взаимодействие эстрогеновой и прогестероновой стимуляций. Было также установлено возрастание количества ПР в результате повышения количества эстрогенов. Исследование в искусственных условиях показало, что прогестерон активирует экспрессию ЭФР, а эстрогены увеличивают также экспрессию его рецепторов.
Беременность и лейомиома
Влияние вызванных беременностью изменений гормонального фона на миому комплексное. Есть многочисленные сообщения о быстром развитии миом во время беременности; однако все проспективные исследования показывают, что большинство миом не изменяется в диаметре с I триместра до родов. Практически невозможно предсказать, какая миома будет увеличиваться.
Основные потенциальные осложнения во время беременности — боль и гибель плода. Боль способна возникать в результате миоматозной дистрофии. Данный феномен может быть следствием некроза, развившегося в связи с нарушением кровоснабжения субсерозной миомы или миомы на ножке. Обычно присутствует локальная болезненность, а при УЗИ выявляют кистозную неоднородную структуру.
К числу наиболее распространенных осложнений, вызванных миомами, относятся преждевременные роды, сильные послеродовые кровотечения и предлежание плаценты. Миомы, локализованные в нижних сегментах матки, могут стать показанием к кесареву сечению в связи с возникшей обструкцией родовых путей или неправильным предлежанием плода.
— Рекомендуем далее ознакомиться со статьей «Диагностика лейомиом матки. УЗИ, МРТ, гистеросальпингография»
Оглавление темы «Лейомиомы матки»:
- Осложнения оперативной гистероскопии. Ранние и поздние
- Маточное кровотечение после гистероскопии. Выбор расширяющей среды
- Лейомиома матки. Классификация
- Клиника лейомиомы матки. Маточные кровотечения и боли
- Эпидемиология лейомиом матки. Распространенность
- Причины лейомиом матки. Механизмы развития
- Диагностика лейомиом матки. УЗИ, МРТ, гистеросальпингография
- Лечение лейомиом. Агонисты ГнРГ
- Тамоксифен, ралоксифен, азоприснил для лечения лейомиом матки
- Хирургическое лечение лейомиом матки. Гистерэктомия
Источник
ММА имени И.М. Сеченова
Миома матки является истинной доброкачественной опухолью матки, которая в свою очередь относится к гормонально зависимым органам. Развивается миома матки из мышечной ткани и в своей структуре содержит миоциты, соединительнотканые компоненты, кровеносные сосуды, перициты, плазматические и тучные клетки.
В зависимости от соотношения паренхимы и стромы эта опухоль ранее имела различные названия: миома, фиброма, фибромиома. Однако принимая во внимание, что узлы миомы чаще развиваются именно из мышечной клетки, т.е. имеет моноклональное происхождение, большинство авторов считают более правильным термин – лейомиома (миома).
Миома матки имеет свои характерные особенности:
– Это самая распространенная опухоль матки у женщин позднего репродуктивного (35–45 лет) и пременопаузального (46–55 лет) возраста.
– Способна к росту, регрессии и даже полному исчезновению в менопаузу. Однако у 10–15% больных в первые 10 лет постменопаузального периода миома матки может увеличиваться, сочетаясь с гиперпластическими процессами эндометрия, пролиферативными заболеваниями яичников.
– Миома матки небольших размеров (до 10 недель беременности) может долго сохранять стабильное состояние, но при воздействии провоцирующих факторов (воспалительный процесс матки и придатков, выскабливание матки, длительное венозное полнокровие органов малого таза) увеличивается быстро и очень быстро (так называемый «скачок роста»).
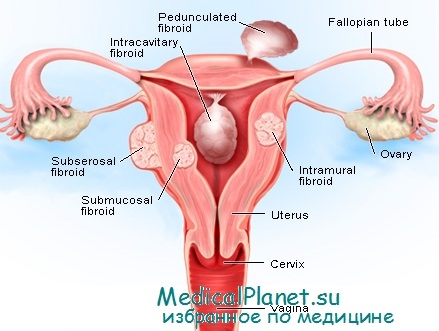
– Характерно многообразие клинических вариантов (малосимптомная, симптомная), зависящих от локализации (подбрюшинная, межмышечная, подслизистая и промежуточные варианты), размеров (небольшие, средние, большие), расположения (дно, тело, перешеек, шейка матки) и характера роста (истинный, ложный).
– По морфологическим особенностям миома матки может быть простая (преобладание соединительнотканного компонента) и пролиферирующая (клеточная, отличающаяся опухолевой прогрессией).
– В зависимости от клетки–родоначальницы миома матки может быть сосудистой, эпителиоидной, аденоматозной, интравенозной. Наблюдается большое морфологическое разнообразие миоматозных узлов, что объясняется ее мезенхимальным происхождением (из полового бугорка), а также из целомического эпителия Мюллерова протока. Из этих клеток дифференцируются миобласты, клетки стромы, перициты, фибробласты, тучные и плазматические клетки.
– В большинстве клинических наблюдений в миометрии вокруг тонкостенного венозного сосуда сразу закладываются несколько зачатков роста, но дальнейший рост и развитие в микроскопический и макроскопический узел происходят с разной скоростью и не всегда в одно и то же время.
– Миома матки имеет автономный рост (аутокринный и паракринный), обусловленный воздействием ростовых факторов и образованием гормонально чувствительных и ростовых рецепторов.
– Как у всякой опухоли, процесс роста и развития миомы матки сопровождается образованием новых сосудов (неоангиогенез), но сосуды миомы отличаются от нормальных, т.к. имеют синусоидный характер с низкорезистентным кровотоком.
– Для пролиферирующих быстро растущих миом характерна повышенная клеточность, крупное гиперхромное ядро, содержащее повышенное количество ДНК.
– Хотя митотическая активность миом матки, как правило, низкая, клетки миомы экспрессируют онкобелки пролиферации (Ki–67) и онкобелки, снижающие процесс апоптоза (bcl–2, bax).
Развитие опухоли от «зачатка роста» и микроскопического узелка без признаков клеточной дифференцировки до макроскопического узла, определяемого при бимануальном исследовании или с помощью УЗИ, занимает в среднем 5 лет.
Начало возникновения узлов миомы матки приходится на 30 лет, когда у женщин накапливаются соматические, гинекологические заболевания и нейроэндокринные нарушения. Суммирование патологических факторов в этом возрасте вызывает соматическую мутацию клеток в органах репродуктивной системы, что, вероятно, играет ведущую роль на стадии формирования пролиферативного компонента при процессах регенерации поврежденных клеток миометрия.
Для последующего роста узлов опухоли требуется дальнейшее накопление неблагоприятных факторов, вызывающих опухолевую прогрессию:
- отсутствие родов и лактации к 30 годам
- аборты
- длительная неадекватная контрацепция
- хронические, подострые и острые воспаления матки и придатков
- стрессы
- ультрафиолетовое облучение
- образование кист и кистом яичников.
На возраст 44–45 лет приходится самая высокая частота оперативных вмешательств (чаще всего это удаление матки), показанием к которым является быстрый рост миомы матки, ее большие размеры, сочетание миомы матки с патологией эндометрия (гиперплазия, атипическая гиперплазия) и яичников (доброкачественные и злокачественные опухоли).
Таким образом, рост опухоли усиливается в возрасте 35–45 лет, когда снижается функциональная активность яичников и их чувствительность к гонадотропной стимуляции, синхронно возрастает продукция гонадотропных гормонов, возникает хроническое функциональное напряжение систем регуляции (нейроэндокринной, гормональной, иммунной) и чаще всего нарушается гемостаз и гомеостаз.
Фоном для усиленного роста миоматозных узлов в пременопаузальном возрасте является не постепенный, достаточно медленный переход к окончанию гормональной функции яичников, а скачкообразный, слишком быстрый и ранний климакс или чрезмерно замедленный переход к менопаузе (поздняя менопауза – 53–55 лет). Отрицательную роль играют длительно существующие нейроэндокринные нарушения, патологический климакс, действие факторов, стимулирующих гиперпластические и пролиферативные процессы в организме (ожирение, нарушение углеводного и липидного обмена, эндометриоз, аденомиоз).
Лечение миомы матки
Лечение миомы матки – очень непростая проблема, т.к. несмотря на гормональную зависимость, эта опухоль весьма гетерогенна.
Хирургическое лечение
Первоначально следует выявить безусловные показания к хирургическому лечению:
- подслизистая локализация миоматозного узла
- большие размеры миоматозно измененной матки (общая величина соответствует матке 14 недельного срока беременности)
- маточные кровотечения, сопровождающиеся хронической гипохромной анемией
- быстрый рост опухоли
- острое нарушение питания миомы (перекрут ножки субсерозного узла, некроз опухоли)
- сочетание миомы матки с рецидивирующей или атипической гиперплазией эндометрия, опухолью яичника
- сдавление мочеточника, мочевого пузыря, прямой кишки (интралигаментарная, ретроцервикальная миома, узел, располагающийся в предпузырной клетчатке)
- наличие миоматозного узла в области трубного угла матки, который является причиной бесплодия
- шеечная и шеечно–перешеечная локализация
- нерегрессирующая и растущая миома матки в постменопаузальном возрасте.
Объем хирургического вмешательства во многом определяется возрастом пациентки.
До 40 лет при наличии показаний к хирургическому лечению, если позволяют технические возможности, производят консервативную миомэктомию. Особенно целесообразно удалять макроскопические миоматозные узлы средних размеров (в диаметре от 2 до 5 см), пока не произошло их интенсивное увеличение в размерах. Предпочтительной методикой является лапароскопическая. При решении вопроса о консервативной миомэктомии необходимо принимать во внимание морфотип опухоли. При пролиферирующей миоме можно удалить несколько узлов, но дальнейший рост продолжают множество других зачатков роста. Поэтому рецидивы при консервативной миомэктомии при миоме матки имеют место в 15–37% случаев.
После 40 лет и постменопаузальном возрасте при наличии хирургических показаний необходима операция удаления миоматозной матки, т.к. если миома не регрессировала в первые 2 года постменопаузы, дальнейшее ее существование сопровождается опасностью возникновения онкопатологии (аденокарцинома, саркома). Известный отечественный онколог Я.В. Бохман (1987 г.) считал, что «нерегрессирующая миома матки в постменопаузальном периоде является маркером онкопатологии органов репродуктивной системы».
По нашим данным, факторами риска роста миомы матки являются: наличие кист и кистом яичников, гиперплазия тека–клеток, пролиферативные процессы эндометрия, несвоевременное прекращение гормональной активности яичников (запоздалая менопауза) и чрезмерная ароматизация андростендиона в жировой клетчатке за счет выраженного ожирения, нарушения углеводного обмена или заболевания печени.
Консервативное лечение
Консервативное лечение, проводимое в репродуктивном возрасте, сразу после выявления миоматозных узлов небольших и средних размеров, позволяет в ряде случаев затормозить дальнейший рост опухоли, предупредить операции по удалению матки, сохранить возможность родить ребенка.
Показания к консервативному лечению:
- молодой возраст пациентки (репродуктивный и пременопаузальный)
- небольшие размеры миоматозно измененной матки (до 10–12 недель беременности)
- межмышечное расположение миоматозных узлов
- относительно медленный рост миомы
- отсутствие деформации полости матки (т.е. центрипетального роста и подслизистой локализации).
Лечение заключается в нормализации системных нарушений, характерных для больных с миомой матки: хроническая анемия, воспалительные процессы матки и придатков, нарушение кровенаполнения органов малого таза с преобладанием венозного застоя и снижением артериального кровоснабжения, нарушение функционального состояния нервной системы и вегетативного равновесия. К методам коррекции системных нарушений относятся следующие:
- соблюдение здорового образа жизни (нормализация сна, рациональное питание, физическая активность, отказ от вредных привычек, контроль за массой тела);
- нормализация половой жизни;
- периодический прием витаминов и микроэлементов в зимне–весенний период (гендевит, пентовит, аевит, фолиевая кислота);
- лечение анемии, волемических и метаболических нарушений;
- нейротропные воздействия, если пациентка проявляет черты дисгармоничной личности.
Если наступила беременность, даже не запланированная, необходимо ее сохранение, т.к. послеродовая инволюция матки, грудное вскармливание ребенка не менее 4–6 месяцев способствуют изменению гистогенеза миомы, переходу ее из пролиферирующей в простую и в ряде случаев прекращению ее дальнейшего развития.
Для профилактики неизбежного удаления матки при росте опухоли большое значение имеет сохранение и поддержание репродуктивной функции до 40 лет.
Эффективность гормональной терапии весьма различается в зависимости от характера гормональных нарушений, наличия и плотности рецепторов в миоматозных узлах и миометрии. Последние преобладают в недлительно существующих миомах небольших размеров, состоящих преимущественно из гладкомышечного клеточного компонента. В фибромах, где превалирует стромальный компонент, а также в узлах больших размеров гормональные рецепторы, как правило, отсутствуют. Поэтому гормональная терапия у этих пациенток мало эффективна.
Тем не менее она используется при коррекции нарушенного менструального цикла. С этой целью применяют прогестерон и его производные (дидрогестерон, ципротерон ацетат), а также производные андрогенов, 19–норстероиды (левоноргестрел, норэтистерон ацетат). Последние нежелательны в молодом возрасте, при ожирении, сахарном диабете, сердечно–сосудистых заболеваниях.
Наиболее перспективными препаратами в лечении больных с миомой матки являются антигонадотропины (гестринон, даназол), которые обладают антиэстрогенным и антипрогестероновым эффектом, вызывая временную аменорею, а также агонисты гонадотропин–рилизинг гормона (трипторелин, гозерелин, бузерелин), вызывающие состояние обратимого гипогонадизма.
Агонисты гонадотропин–рилизинг гормона
Синтетические аналоги гонадотропин–рилизинг гормона (а–ГнРГ) широко применяются в гинекологической практике, являясь эффективными средствами медикаментозного лечения эндометриоза, миомы матки, меноррагии, гиперандрогении яичникового генеза, бесплодия. В основе их терапевтического действия лежит эффект десенситизации гипофиза с последующей блокадой секреции гонадотропинов и, соответственно, половых стероидов. Эта блокада является обратимой и после отмены а–ГнРГ чувствительность аденогипофиза к гипоталамической стимуляции полностью восстанавливается.
На фоне лечения а–ГнРГ отмечается уменьшение клеточности и гипоплазия клеток миомы, узлы отграничиваются от окружающих тканей, возрастает степень их гиалинизации и коллагенизации, утолщаются стенки сосудов. На ультраструктурном уровне отмечается повреждение клеток с разрывом клеточной мембраны, сморщивание цитоплазмы и интенсивная лимфоцитарная инфильтрация, т.е. некроз клеток в сочетании с повышенным апоптозом, а главное, угнетением пролиферативной активности в миоме.
Снижение циркулирующего в крови эстрадиола способствует повышению сосудистого сопротивления в маточных артериях и в артериях, питающих миоматозный узел, что приводит к редуцированию маточного кровотока и сопровождается уменьшением размеров узла.
Высказано предположение о прямом влиянии а–ГнРГ на опухоль (в ткани миомы выявлены рецепторы ГнРГ). Еще один механизм действия а–ГнРГ может быть связан с их влиянием на факторы локальной регуляции. Доказано, что на фоне их приема достоверно снижается концентрация ЭФР, влиящего на процесс редукции опухоли на уровне миомы или миометрия.
Различные типы а–ГнРГ отличаются друг от друга по биологической активности, времени полураспада, форме выпуска и срокам обратимости эффекта, что не имеет клинического значения.
В России зарегистрированы следующие препараты а–ГнРГ:
1. Депо–гозерелин 3,6 мг п/к; трипторелин 3,75 мг в/м и п/к; лейпрорелин 3,75 мг в/м Препарат представляет собой готовый набор с различными способами введения. Лечение начинают со 2–4 дня менструального цикла: 1 инъекция каждые 28 дней.
2. Эндоназальный спрей – 0,2% раствор бузерелина ацетата 0,9 мг в сутки. Лечение начинают с 1-2 дня менструального цикла: 0,15 мг в каждый нососвой ход 3 раза в день через равные промежуькт времени.
Подготовка к оперативному вмешательству с помощью а–ГнРГ при наличии миомы матки позволяет проводить щадящие органосохраняющие операции с использованием эндоскопической техники. Терапия а–ГнРГ способствует уменьшению размеров миоматозных узлов и связанных с ними симптомов и тем самым позволяет сократить время операции и уменьшить объем кровопотери. После лечения а–ГнРГ возможно наступление беременности.
К настоящему времени описано несколько стратегий длительной терапии а–ГнРГ, позволяющих избежать выраженных побочных явлений при сохранении высокой клинической эффективности:
- Add–back режим – сочетание а–ГнРГ с небольшими дозами эстрадиола.
- On–off режим – терапия а–ГнРГ прерывистыми курсами (трехмесячная терапия с трехмесячным перерывом до 2 лет).
- Drow–back – применение высоких доз а–ГнРГ в течение 8 недель с переходом на пониженные дозы препарата в течение 18 недель.
Вариабельность ответа отдельных миоматозных узлов на лечение связана со степенью гиалинизации и дегенеративных изменений в опухоли, потерей чувствительности к антиэстрогенным воздействиям; первоначальным объемом матки. Вероятный ответ на лечение может быть предсказан в большинстве случаев через 4 недели после первой инъекции.
Препараты хорошо переносятся, не обладают антигенными свойствами, не кумулируют, не влияют на липидный спектр крови. Побочные эффекты: приливы, потливость, сухость во влагалище, головная боль, депрессия, нервозность, изменение либидо, себорея, периферические отеки, ухудшение проспективной памяти, снижение плотности костной ткани.
Прекращение терапии ведет к восстановлению нормального менструального цикла и эстрогенного статуса приблизительно через 59–94 дня после отмены препарата и быстрому повторному росту миомы матки до первоначальных размеров (в течение первых 3–4 менструальных циклов) со всеми клиническими симптомами (хотя некоторые авторы отмечают, что эти симптомы менее выражены).
Антигонадотропины
Даназол назначают по 100–200 мг 1 раз в день (через 30 мин после ужина) в течение 3,5–5 месяцев с использованием методик, позволяющих контролировать их влияние на организм и регрессию миоматозных узлов. Каких–либо побочных эффектов при использовании низкодозированных препаратов мы не наблюдали. У ряда больных не наступает аменорея, а имеет место гипоменструальный синдром. В процессе лечения наблюдается уменьшение размеров матки на 50–60%.
Далее необходимо продолжить общеукрепляющую терапию для нормализации нарушений системы регуляции. На фоне восстановления менструального цикла рекомендуется наступление беременности. Наш опыт свидетельствует о наилучшем эффекте в лечении миомы матки препаратом даназол в низкой дозировке. Морфологическое исследование удаленных после лечения узлов показывает низкую митотическую активность, снижение клеточности и повышение содержания компонентов экстрацеллюлярного матрикса, т.е., по сути, возможность перехода пролиферирующей миомы в простую. Последующая лапароскопическая консервативная миомэктомия дает наименьший процент рецидивов (из 49 наблюдаемых нами пациенток дальнейший рост через 2 года отмечен только у 2 женщин).
Профилактика миомы матки
Возможна ли профилактика миомы матки? По–видимому, возможна. Кроме общих рекомендаций по соблюдению рационального режима жизни, предупреждению распространенных болезней в детском и взрослом возрасте, играют роль исключение абортов, своевременная коррекция гормональных нарушений, адекватное лечение гинекологических заболеваний. Существует и специфическая профилактика. Это своевременная реализация репродуктивной функции. Первые роды рекомендуются в 22 года, вторые в 25 лет, последующие планируемые роды до 35 лет. Поздние первые роды приводят к преждевременному постарению миоцитов, снижению адаптационной способности к растяжению и сокращению. Аборты и воспаления повреждают структуру миометрия. На фоне нарушенного гомеостаза процесс регенерации участков миометрия переходит в пролиферативную опухолевую прогрессию.
Следует принимать во внимание, что самый частый срок обнаружения миомы матки приходится на 30–35 лет, когда суммируются действия повреждающих факторов.
Необходимо сохранять первую беременность, особенно у молодых женщин с так называемой наследственной миомой. Аборт вызывает рост миоматозных узлов и из микроскопических узлов интенсивно формируются растущие миомы. Следует избегать чрезмерного ультрафиолетового облучения, повышенных температурных воздействий, особенно после 30 лет. При наличии наследственного риска (миома матки у матери и близких родственниц) опухоль развивается на 5–10 лет раньше, т.е. в 20–25 лет. Продолжение грудного вскармливания в течение 4–6 месяцев после родов нормализует содержание пролактина, который влияет на изменение гистогенеза миомы.
В заключение необходимо подчеркнуть, что миома матки является результатом соматической мутации клеток миометрия вследствие многочисленных повреждающих факторов. Поэтому в основе профилактики должны превалировать здоровый образ жизни и сохранение репродуктивного здоровья женщин.
Источник


