Апоптоз при миоме матки
Лейомиомы определяют как доброкачественные моноклональные разрастания гладкой мышечной ткани. Каждая моноклональная миома может ассоциироваться с различными хромосомными транслокациями, дупликациями и делециями. Многие, однако не все, миомы содержат имеют цитогенетические отклонения, в то время как мышечная оболочка матки имеет нормальный кариотип — обычно они включают хромосомы 7,12 и 14. Большинство мутаций появляется в генах, отвечающих за клеточный рост или ответственных за архитектурную транскрипцию.
Выявлено два наследственных нарушения, при которых миомы матки — часть генетически обусловленного синдрома:
• Врожденный лейомиоматоз в сочетании с раком, происходящим из клеток почечного эпителия. Это аутосомно-доминантный синдром (гладкомышечные опухоли матки, кожи и почек).
• Синдром легочного лейомиоматоза и лимфангиомиоматоза. Возникает в результате мутаций в одном из двух генов, отвечающих за туберозный склероз — синдром, приводящий к развитию гамартом ы со сложной структурой.
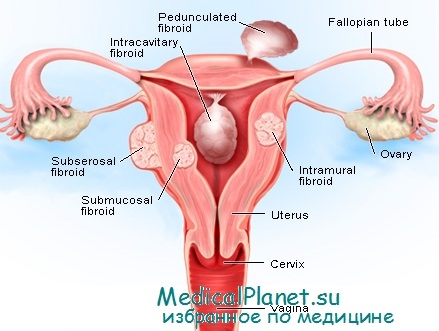
В большинстве случаев миомы макроскопически проявляются как дискретные круглые опухоли, которые светлее, чем окружающая мышечная ткань матки, с блестящими на разрезе образованиями жемчужно-белого цвета. К особенностям тканевой структуры относится наличие переплетающихся тяжей из гладкомышечных волокон, между которыми расположена фиброзная ткань.
Влияние стероидных гормонов лежит в основе теории «клональной экспансии миомы». Миомы восприимчивы к эстрогенам и прогестерону, поэтому, скорее всего, они могут увеличиваться в размере и вызывать сопутствующую симптоматику у женщин репродуктивного возраста. С другой стороны, при наличии миом не отмечено увеличения концентрации циркулирующих эстрогенов и прогестерона в сыворотке крови.
Факторы, инициирующие развитие опухоли и еще подлежащие уточнению генетические факторы, связаны с ключевыми соматическими мутациями, способствующими развитию лейомиоцита из нормальной мышечной клетки и восприимчивыми к воздействию эстрогенов и прогестерона. Существенную роль в развитии миом имеет интегральное воздействие ЭР, ПР и рецепторов ЭФР. Как показал ряд исследований, по сравнению с нормальным миометрием в миомах отмечена повышенная концентрация рецепторов, чувствительных к эстрогенам, и ПР.
В миомах отмечен повышенный синтез ароматазы р450. В свете этого, наряду с воздействием циркулирующих эстрогенов на ЭР, большое значение в потенцировании действия эстрогенов на миоциты может иметь местная конверсия циркулирующих андрогенов в эстрогены.
Обычно считали, что эстроген — главный гормональный медиатор роста миом. Хотя прогестины применяют для лечения кровотечения при симптомной миоме, недавние исследования показывают, что прогестерон может играть значительно большую роль в качестве медиатора роста миом, чем это считали раньше. Доказано, что антипрогестин RU486 (мифепристон) вызывает уменьшение размера миом, а еще одно исследование показало, что в миомах в секреторную фазу увеличивается количество митозов по сравнению с пролиферативной фазой.
Развитие опухолевых новообразований — результат ускоренной клеточной пролиферации, опережающей тормозящий эффект апоптоза. Доказано, что апоптоз приостанавливается в миомах матки. Воздействие прогестерона повышает количество противодействующего апоптозу белка bcl-2, поэтому стимуляция роста миомы может быть результатом подавления апоптоза прогестероном. In vitro было отмечено, что при добавлении прогестерона к культуре клеток лейомиомы увеличивался синтез bcl-2 по сравнению с контрольными наблюдениями. В нормальном миометрии чрезмерного образования bcl-2 в присутствии прогестерона не отмечено.
В целом на процесс апоптоза влияет не только семейство bcl-2, но также соотношение Fas/FasL и Rb-1. Martel и соавт. описали различные механизмы развития апоптоза, недостаточно выраженные в лейомиомах, и наметили возможные «мишени» для терапии миом. Роль апоптоза в патогенезе миом — перспективная область будущих исследований с огромным потенциалом для применения в медицинской практике.
Кроме того, в патофизиологии роста миом было обнаружено синергичное взаимодействие эстрогеновой и прогестероновой стимуляций. Было также установлено возрастание количества ПР в результате повышения количества эстрогенов. Исследование в искусственных условиях показало, что прогестерон активирует экспрессию ЭФР, а эстрогены увеличивают также экспрессию его рецепторов.
Беременность и лейомиома
Влияние вызванных беременностью изменений гормонального фона на миому комплексное. Есть многочисленные сообщения о быстром развитии миом во время беременности; однако все проспективные исследования показывают, что большинство миом не изменяется в диаметре с I триместра до родов. Практически невозможно предсказать, какая миома будет увеличиваться.
Основные потенциальные осложнения во время беременности — боль и гибель плода. Боль способна возникать в результате миоматозной дистрофии. Данный феномен может быть следствием некроза, развившегося в связи с нарушением кровоснабжения субсерозной миомы или миомы на ножке. Обычно присутствует локальная болезненность, а при УЗИ выявляют кистозную неоднородную структуру.
К числу наиболее распространенных осложнений, вызванных миомами, относятся преждевременные роды, сильные послеродовые кровотечения и предлежание плаценты. Миомы, локализованные в нижних сегментах матки, могут стать показанием к кесареву сечению в связи с возникшей обструкцией родовых путей или неправильным предлежанием плода.
— Рекомендуем далее ознакомиться со статьей «Диагностика лейомиом матки. УЗИ, МРТ, гистеросальпингография»
Оглавление темы «Лейомиомы матки»:
- Осложнения оперативной гистероскопии. Ранние и поздние
- Маточное кровотечение после гистероскопии. Выбор расширяющей среды
- Лейомиома матки. Классификация
- Клиника лейомиомы матки. Маточные кровотечения и боли
- Эпидемиология лейомиом матки. Распространенность
- Причины лейомиом матки. Механизмы развития
- Диагностика лейомиом матки. УЗИ, МРТ, гистеросальпингография
- Лечение лейомиом. Агонисты ГнРГ
- Тамоксифен, ралоксифен, азоприснил для лечения лейомиом матки
- Хирургическое лечение лейомиом матки. Гистерэктомия
Источник
Миома матки является доброкачественным новообразованием, связанным с нарушением гормонального фона. Удаление матки в 50-70% случаев проводится при лейомиоме. Нелеченная опухоль снижает качество жизни, приводит к тяжелым кровотечениям, сдавлению соседних органов и бесплодию. Медикаментозное лечение миомы матки позволяет сохранить репродуктивную функцию и улучшить состояние. Но его назначают не во всех случаях.
Показания для медикаментозного лечения

Частота развития доброкачественной опухоли увеличивается у пациенток молодого возраста. Миому обнаруживают даже у девушек после менархе. За последних 40 лет наблюдений у женщин в возрасте до 30 лет заболеваемость возросла с 2% до 12%. В среднем миому обнаруживают в 33-35-летнем возрасте, когда многие женщины планируют беременность. Поэтому на радикальную операцию соглашаются не все.
Медикаментозное лечение лейомиомы назначают в следующих случаях:
- желание сохранить детородную функцию;
- малосимптомное течение болезни;
- размер матки не более 12 недель беременности;
- узел расположен интерстициально или субсерозно на широком основании.
При тяжелых экстрагенитальных заболеваниях, которые увеличивают риск неблагоприятного исхода хирургического вмешательства или анестезии, также ограничиваются медикаментозной терапией. К таким состояниям относятся:
- плохо контролируемая гипертензия;
- тяжелые пороки сердца;
- нарушения мозгового кровообращения;
- патология свертывающей системы крови;
- острые сосудистые заболевания;
- лихорадочные состояния;
- острые инфекции.
Консервативная терапия может быть этапом комплексного лечения. Гормональные препараты способны вызвать уменьшение размеров узлов. Эта особенность применяется при подготовке к миомэктомии, чтобы снизить травматизацию матки.
Лекарственные средства не используют для медикаментозного лечения миомы матки больших размеров. Это связано с особенностями морфологического строения крупных узлов. В начальной стадии заболевания опухоль состоит из мышечных волокон и небольшого количества прослоек из соединительной ткани. Постепенно их соотношение выравнивается, а в больших узлах начинают преобладать фиброзные ткани. Медикаментозные средства приводят к уменьшению размера узлов за счет миоцитов и мало влияют на соединительнотканные элементы. Поэтому использование гормональных средств не оправдано и увеличивает риск побочных эффектов.
Отдают предпочтение хирургическому лечению в следующих состояниях:
- тяжелые кровотечения, обильные менструации, которые приводят к анемии;
- хроническая тазовая боль;
- узел расположен подслизисто на ножке, межсвязачно, шеечно;
- размер матки больше 12 недель беременности;
- увеличенная матка нарушает функцию соседних органов;
- быстрый рост миомы;
- опухоль обнаружена в период постменопаузы.
Женщинам с бесплодием также рекомендуют органосохраняющие операции или другие способы лечения, которые помогут избавиться от миомы и восстановить репродуктивную функцию.
Препараты для терапии миомы
Нужно помнить, что медикаментозные препараты не приведут к устранению причин заболевания. Они борются с последствиями гормональных нарушений, помогают уменьшить выраженность неприятных симптомов, улучшить качество жизни. Но через 2-3 месяца после окончания лечения размеры опухоли приближаются к изначальным.
Медикаментозное лечение назначают на срок не более 6 месяцев. Это связано с большим количеством побочных эффектов препаратов. Основное направление терапии – подавление синтеза эстрогенов. Угнетение работы яичников вызывает искусственный климакс, что заканчивается снижением минерализации костей.
Результаты лечения оценивают каждых 3 месяца. Если нет регресса узлов, тактику пересматривают в пользу операции или малоинвазивных методов терапии. Перед назначением медикаментов врач должен оценить не только возможную эффективность, но и безопасность. В некоторых случаях органосохраняющая операция, эмболизация маточных артерий или ФУЗ-абляция меньше вредят общему состоянию и выгодны экономически.
Для медикаментозного лечения миомы матки небольших размеров применяют гормональные и негормональные средства. Последние меньше влияют на размер узла, но помогают устранить неприятные симптомы болезни.
Негормональные средства
Уменьшить боль в малом тазу и интенсивность менструального кровотечения помогают нестероидные противовоспалительные средства (НПВС). При миоме применяют:
- ацетилсалициловую кислоту;
- Диклофенак;
- Ибупрофен;
- Кеторолак;
- Напроксен;
- Индометацин;
- Пироксикам;
- Нимесулид;
- Мелоксикам.
Исследования показали, что у женщин с фибромиомой увеличен синтез простагландинов. Эти биологически активные вещества усиливают сокращения матки во время менструации, что приводит к сильным болевым ощущениям. НПВС снижают синтез простагландинов. Эффекты проявляются в виде уменьшения боли, снижения потери менструальной крови.

Нестероидные противовоспалительные средства
В Кохрановском обзоре 2013 года показано, что для уменьшения симптомов можно применять любое из нестероидных противовоспалительных средств. Эффект от их использования сопоставим с другими препаратами:
- этамзилатом натрия;
- прогестагенами;
- оральными контрацептивами.
Нестероидные противовоспалительные препараты относятся к разным химическим веществам, имеют отличия в метаболизме и механизме действия. Но исследования показали, что у них нет отличий в эффективности.
НПВС эффективны при асептическом некрозе узлов. Их назначают женщинам для уменьшения боли после ФУЗ-абляции или ЭМА.
У беременных с лейомиомой во 2 и 3 триместре могут возникать болевые ощущения и небольшие кровянистые выделения. Им назначают Ибупрофен как более эффективный и безопасный препарат. Лечение проводят короткими курсами.
Гормональные изменения во время беременности могут приводить к активации роста узлов или их угнетению. Дегенерация протекает с выраженной болью. С ней помогает справиться Индометацин.
Превосходит НПВС по способности уменьшать кровотечение транексамовая кислота. Она относится к антифибринолитикам. Механизм действия проявляется в подавлении активации плазминогена крови. Это вещество запускает каскад реакций, направленных на растворение тромба в просвете поврежденного сосуда. Транексам не дает активировать фибринолиз, оказывает системное кровоостанавливающее действие.
Механизм действия Транексама аналогичен аминокапроновой кислоте. Но эффективность его выше в 20 раз. Объем кровопотери на фоне лечения снижается на 40%. Транексамовую кислоту назначают курсами во время менструации. FDA рекомендует принимать в сутки не более 4,0 г, максимальный курс терапии 5 дней.
При соблюдении рекомендованных доз не возникает побочных эффектов. В редких случаях возможно появление головной боли, тошноты и заложенности носа.
Лекарства, влияющие на гормональный фон
Репродуктивный возраст может протекать с изменениями гормонального фона, которые проявляются относительной или абсолютной гиперэстрогенией. Поэтому назначение лекарственных средств, которые влияют на гормональную систему, обосновано патогенетически.
Прогестагены
Стероидные гормоны из группы прогестагенов используются в разных лекарственных формах. Их эффект связан с наличием рецепторов в матке и гипоталамусе. Центральное действие блокирует гипоталамо-гипофизарно-яичниковую ось. В ответ на воздействие снижается синтез эстрогенов, исчезают симптомы миомы, а узлы небольшого размера регрессируют. При непрерывном дозировании прогестагенов в эндометрии происходят изменения, которые постепенно приводят к его атрофии и уменьшению менструальных кровотечений. Прогестагены подавляют синтез простагландина, поэтому женщины отмечают уменьшение болевого синдрома.
Для внутриматочного использования разработана гормональная система Мирена. Это спираль, контрацептивное действие которой дополнено левоноргестрелом. Ее устанавливают на 5 лет. Ежедневно из спирали выделяется 20 мкг левоноргестрела. По данным исследований, эффективность Мирены при миоме 74-97%. Она уменьшает кровопотерю, помогает восстановить концентрацию гемоглобина и вылечить анемию.
Спираль Мирена
Мирена действует только в полости матки. Она снижает пролиферацию эндометрия, но не влияет на функцию яичников и гипофиза. Исследования 2010 года показали, что под действием левоноргестрела тормозится рост миоматозных узлов, запускается апоптоз. Периодическое наблюдение за пациентками показало, что лейомиомы небольшого размера регрессируют. Своевременное назначении Мирены приводит к снижению количества гистерэктомии у 89% женщин.
Долгое время в гинекологии для медикаментозного лечения миомы матки применяли препараты прогестерона для приема внутрь, например, Дюфастон. На фоне терапии отмечали следующие эффекты:
- уменьшение болевого синдрома;
- снижение кровопотери;
- торможение роста узлов.
Дюфастон назначали в нескольких режимах:
- циклично – с 14 по 26 день цикла;
- 21-дневный режим – с 5 по 26 день.
Более эффективным считается длительный прием прогестагенов. Но позже исследования показали, что такой зависимости нет.
Наблюдения за беременными с миомой и целенаправленные клинические исследования выявили, что под влиянием прогестагенов опухоль может активироваться и ускорить свой рост. В ее тканях обнаружили увеличенное количество рецепторов к прогестерону. Поэтому прием этого препарата не улучшает состояние женщины, а ускоряет появление тяжелых симптомов болезни.
Низкодозированные оральные контрацептивы
У женщин репродуктивного возраста после медикаментозной терапии и регресса опухоли необходимо перейти на поддерживающее лечение. Для стабилизации состояния используют низкодозированные комбинированные оральные контрацептивы:
- Мидиана;
- Ярина;
- Три-мерси;
- Линдинет-30;
- Жанин;
- Фемоден;
- Регулон;
- Марвелон;
- Ригевидон;
- Белара;
- Диане-35;
- Хлое.
Механизм действия основан на ежедневном поступлении в организм фиксированной дозировки эстрогенов и прогестагенов, которая не изменяется на протяжении цикла у монофазных контрацептивов. При этом яичники переходят в спящий режим: не созревает фолликул, нет выброса эстрогенов и повышения прогестерона в лютеиновую фазу. На фоне приема оральных контрацептивов толщина эндометрия уменьшается, количество менструального отделяемого уменьшается по объему и продолжительности.

Низкодозированные комбинированные оральные контрацептивы
Низкая концентрация эстрогенов подавляет активность клеток миоматозной опухоли. После достижения регресса узлов постоянное применение КОКов не позволит им начать новый рост.
Поддерживающая терапия необходима женщинам, не достигшим времени естественного наступления климакса. После 50-55 лет оральные контрацептивы могут не использоваться.
Агонисты гонадотропин-рилизинг гормона
Это искусственно синтезированные белковые соединения, которые по структуре аналогичны человеческому гонадотропин-рилизинг гормону. Но в отличие от эндогенного вещества, они связываются с рецепторами на длительное время. Это приводит к угнетению гипоталамо-гипофизарной функции и работы яичников, снижает синтез эстрогенов. Для медикаментозного лечения миомы используют следующие вещества:
- лейпролида ацетат – препараты Люкрин Депо, Луприд Депо;
- трипторелин – препараты Трипторелин-лонг, Диферелин, Декапептил;
- гозерелин – препарат Золадекс.
Клинические рандомизированные исследования показали, что применение препаратов этой группы позволяет уменьшить размер миомы на 50%. Люкрин Депо и его аналоги не только приводит к регрессу лейомиомы, но и уменьшает объем матки, подавляет кровотечения, улучшает общее самочувствие.
Агонисты гонадотропин-рилизинг гормонов часто назначают при предоперационной подготовке. Терапия в течение 3 месяцев до хирургического вмешательства значительно улучшает прогноз. За этот срок успевает восстановиться нормальная концентрация гемоглобина. Поэтому в послеоперационном периоде кровопотеря переносится легче.
Медикаментозное лечение до операции приводит к значительному уменьшению размера внутренних половых органов. Стандартная техника гистерэктомии подразумевает операцию через переднюю брюшную стенку из-за большого размера опухоли. Но в некоторых исследовательских центрах удалось уменьшить количество вмешательств путем лапаротомии и выполнять удаление матки через влагалище. Такая операция меньше травмирует женщину, уменьшается риск послеоперационных осложнений и ускоряется реабилитация.
Продолжительность медикаментозного лечения агонистами ГрГ ограничена 6 месяцами. Это связано с тяжелыми побочными реакциями. Снижение функции яичников вызывает искусственный климакс со всеми характерными для него симптомами:
- приливы жара;
- перепады настроения;
- вагинит;
- нарушение работы сердца;
- сухость влагалища;
- снижение минеральной плотности костей.
Многие женщины на фоне терапии жалуются на боли в трубчатых костях. Назначение препаратов кальция не всегда позволяет восполнить дефицит минералов.
Антагонисты гонадотропин-рилизинг гормона
Механизм действия основан на блокировании выброса лютеинизирующего гормона и торможении созревания фолликула. Это применяется в протоколах ЭКО. В исследованиях отмечается, что использование лекарства в течение 28 дней приводит к уменьшению объема матки, но не влияет на размер узлов. Для лечения миомы препараты этой группы не применяются, но они не противопоказаны у женщин с признаками болезни, которые прибегают к вспомогательным репродуктивным технологиям.
Ингибиторы ароматазы
Лекарственные средства этой группы приводят к торможению синтеза эстрогенов, но они не применяются для терапии миомы. Действие развивается постепенно. В периферических тканях снижается активность фермента ароматазы, по цепочке подавляется синтез эстрона, а затем эстрадиола из андрогенов.
В Кохрановском исследовании при лечении женщин с раком молочной железы и миомой матки в постменопаузу было выявлено побочное действие препарата – уменьшение размера миомы на 50%.
Но выраженность побочных реакций из-за недостатка эстрогенов не позволяет применять их целенаправленно для медикаментозной терапии миомы.
Препараты, влияющие на рецепторы к прогестерону
В 90% клеток миоматозной опухоли увеличено количество рецепторов к прогестерону. Взаимодействие с прогестероном приводит к выработке факторов роста и к ускорению увеличения размеров патологического очага. Одновременно происходит подавление факторов, запускающих апоптоз клеток. Поэтому клетки в миоме активно делятся, но не гибнут.
Разработка способов медикаментозной терапии привела к созданию следующих групп препаратов, модулирующих рецепторы к прогестерону:
- агонисты прогестерона (прогестерон и его аналоги);
- антагонисты прогестерона (Мифепристон, или Гинестрил);
- селективные модуляторы (Эсмия).
Прогестерон применяется для консервативной медикаментозной терапии миомы редко. Это связано с его способностью стимулировать рост опухоли. Некоторые врачи допускают его назначение на начальных этапах болезни, когда размер узлов маленький. В этой стадии в патологических очагах количество рецепторов еще не увеличилось до критического. При больших размерах опухоли прогестерон не назначают. Остальные препараты дают хороший эффект, но могут сопровождаться побочными действиями.
Мифепристон
Механизм действия основан на блокировании рецепторов прогестерона и глюкокортикоидов в матке. Гинестрил применяется для лечения миомы матки до 12 недели беременности. Использование препарата тормозит рост узла и вызывает его регресс. Курс терапии 3 месяца. После прекращения терапии патологические очаги также возобновляют свой рост, но это происходит не так активно, как после лечения Золадексом и его аналогами.

Препараты мифепристона
У Гинестрила большое количество противопоказаний. Его не назначают женщинам во время беременности. Блокирование рецепторов прогестерона приведет к выкидышу. Этот эффект применяется для медикаментозного аборта до 9 недель. Другими противопоказаниями являются:
- длительное лечение глюкокортикоидами;
- недостаточность надпочечников;
- острая и хроническая почечная недостаточность;
- порфирия;
- лечение антикоагулянтами и нарушение свертываемости крови;
- субмукозный рост узлов;
- опухоли яичников;
- гиперплазия эндометрия;
- индивидуальная непереносимость.
Побочные реакции при соблюдении дозировки возникают редко. Частота их не установлена. В инструкции к Гинестрилу указано, что могут развиваться:
- тошнота;
- рвота;
- аллергические реакции;
- головная боль;
- нарушения менструального цикла;
- гиперплазия эндометрия.
После отмены препарата побочные эффекты устраняются самостоятельно и не требуют специального лечения.
Эсмия
Действующим веществом является улипристала ацетат. Он обладает действием агонистов и антагонистов рецепторов прогестерона. Женщинам назначают по 1 таблетке в сутки, продолжительность курса подбирают индивидуально. Чаще всего она составляет 12 недель.
Эсмия
Прием лекарства начинают с первого дня менструального цикла. Это приводит к остановке кровотечения. На фоне медикаментозной терапии месячные в последующем цикле не начинаются.
Эффект на лейомиому проявляется в уменьшении ее размеров. Лекарственное средство запускает апоптоз клеток и тормозит их деление. Уменьшение объема маточного кровотечения помогает восстановить нормальную концентрацию гемоглобина.
Эффект после начала приема Эсмия развивается быстрее, чем при лечении Золадексом. Аменорея в среднем наступает уже на 7 сутки. Побочные действия на фоне терапии выражены меньше, но могут беспокоить:
- головные боли;
- перепады настроения;
- акне;
- боли в животе, метеоризм;
- диспепсия;
- мышечные боли, ломота в конечностях;
- болезненность молочных желез;
- аменорея;
- увеличение толщины эндометрия;
- отеки;
- увеличение концентрации холестерина в крови.
Приливы и другие эффекты, связанные с дефицитом эстрогенов, не беспокоят. Выработка собственного гормона не подавляется, поэтому в крови сохраняется его нормальная концентрация.
Утолщение эндометрия в норме не приводит к трансформации клеток и исчезает через 3 месяца после прекращения терапии. Нормальный менструальный цикл восстанавливается через 4-6 недель после окончания курса. Использование Эсмия не гарантирует полное избавление от опухоли. Она начнет свой рост, но позже и не так активно, как после применения агонистов ГрГ.
Медикаментозная терапия лейомиомы не позволяет избавиться от опухоли. Но она дает шанс сохранить репродуктивную функцию и успеть родить ребенка после окончания приема препаратов.
Читайте также: Удаление миомы матки
Источник


