Е м вихляева миома матки
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 ноября 2017;
проверки требуют 13 правок.
Миома матки (также фибромиома, лейомиома) — это доброкачественная опухоль, возникающая в мышечном слое матки — миометрии. Является одним из самых распространенных заболеваний у женщин, достигая частоты 12 — 25% от всех гинекологических заболеваний[1]. Наиболее высокая заболеваемость миомой матки приходится на поздний репродуктивный период и перед климаксом[2]. Существует мнение, что истинная распространенность миомы значительно больше и достигает более 70% как в России, так и за рубежом[1][3].
Узел миомы представляет собой клубок хаотично переплетающихся гладкомышечных волокон округлой формы. Большинство узлов имеют диаметр от нескольких миллиметров до нескольких сантиметров, но иногда они могут достигать больших размеров и веса в несколько килограммов. Так, самый большой узел, о котором имеется упоминание в мировой литературе, весил 63 кг[источник не указан 2038 дней].
Причины появления миомы до конца не изучены. Хотя очевидная роль гормональных факторов в развитии миомы была описана еще в 80-е годы прошлого века в трудах В.М. Бреслера и Г.А. Савицкого[4][5][6], остается неясным вопрос первичности или вторичности миомы по отношению к гормональным сдвигам[7]. Существенную роль играют такие факторы риска, как позднее начало месячных, обильные менструации, медаборты, воспалительные заболевания женских половых органов [1][8]. Другим значимым фактором риска считают избыточную массу тела в сочетании с гиподинамией и стрессами [1][9].
Для лечения миомы матки на протяжении многих десятилетий применяется хирургическое удаление узлов (вылущивание) и даже, во многих случаях крупных узлов, — удаление матки. В настоящее время разработаны эффективные схемы консервативного лечения на основе агонистов ГнРГ, а также эффективные эндоваскулярные методики безоперационного лечения миомы с помощью введения в артерии миомы микроэмболов, перекрывающих кровоток в опухоли[10]. Данные методики позволяют сохранить матку в тех случаях, когда раньше была показана гистерэктомия[11].
Механизм развития[править | править код]
Каждый узел миомы возникает в результате неправильного деления одной гладкомышечной клетки, и поэтому все клетки в узле являются идентичными. Миома матки считается гормонально-зависимой опухолью. Доказательством этого служат следующие факторы:
- обнаружение в опухоли рецепторов к половым гормонам,
- появление миомы в репродуктивном возрасте, когда уровень эстрогенов высокий,
- регресс опухоли после менопаузы, когда уровень эстрогенов достигает минимума,
- появление миомы у некоторых женщин в постменопаузе на фоне приема эстрогенных препаратов.
- механизм гиперэстрогении:
- лейомиомы преобразуют эстрадиол в эстрон;
- клетки лейомиомы содержат большую плотность рецепторов (гормонзависимая опухоль) по сравнению с нормальным миометрием;
- лейомиомы содержат высокие уровни цитохром p450 ароматазы, который позволяет преобразовывать андрогены в эстрогены.
Распространенность[править | править код]
Миома матки — самая распространенная опухоль у женщин. По различным оценкам, она возникает у каждой второй-четвертой женщины в течение репродуктивного периода, преимущественно после 30 лет
.
Классификация[править | править код]
По количеству узлов:
- одиночная миома;
- множественная миома.
По расположению узлов в матке:
- Подслизистые узлы (субмукозная миома) — расположены ближе к полости матки. Встречаются относительно редко, иногда они имеют тонкую ножку и могут опускаться из матки в шейку матки или во влагалище; в этом случае говорят о «рождающемся» узле миомы.
- Межмышечные узлы (интерстициальную, интрамуральную) — узлы находятся в стенке матки в мышечном слое.
- Подбрюшинные узлы (субсерозная миома) — расположены на наружной стороне матки, ближе к брюшной полости. Могут иметь основание меньшего диаметра, чем сам узел; в этом случае употребляют термин «узел на ножке».
- Межсвязочные узлы (интралигаментарная миома).
- Шеечная миома.
Наиболее распространенной является интерстициальная миома матки. По данным разных авторов её частота колеблется от 50 до 61% и более. Частота субсерозной миомы от 26 до 35%, субмукозной не более 13% [12].
В 50% случаев миома матки протекает бессимптомно[13]. Бессимптомное течение более характерно для небольшой одиночной или множественной миомы с межмышечным и подбрюшинным расположением[источник не указан 2030 дней].
Симптомы[править | править код]
Наиболее типичными симптомами миомы матки являются сильные менструальные кровотечения (меноррагии), чувство давления и боли внизу живота. Меноррагии более характерны для подслизистых миом. При росте миомы менструации постепенно становятся более обильными и продолжительными, нередко приводя к развитию малокровия (анемии). Чувство тяжести или давления внизу живота более характерно для межмышечной и подбрюшинной миомы, особенно при больших размерах узлов. Боли, как правило, возникают во время менструаций и носят схваткообразный характер, но могут быть постоянными. Боли также могут иметь внезапный режущий характер, что отмечается при очень редком осложнении — перекруте ножки подбрюшинного узла. К более редким симптомам миомы матки относят бесплодие и нарушение функции соседних органов: мочевого пузыря и прямой кишки.
Диагностика[править | править код]
Для диагностики миомы матки наиболее информативным методом является ультразвуковое исследование, при котором миома обнаруживается в виде округлых очагов пониженной эхогенности (имеющих менее плотную структуру, чем миометрий). В некоторых случаях для дифференциальной диагностики миомы матки и опухоли яичника используют магнитно-резонансную томографию.
Основные методы диагностики миомы матки:
- гинекологический осмотр;
- стандартные гинекологические анализы на микрофлору, цитологию, инфекции;
- анализ крови на гормоны;
- трансвагинальное или трансабдоминальное УЗИ;
- магнитно-резонансная томография (МРТ);
- биопсия.
Лечение[править | править код]
Тактика лечения миомы в значительной мере определяется размерами и количеством узлов, а также степенью выраженности симптомов. При бессимптомных миомах малых размеров часто применяется выжидательная тактика, хотя её оправданность остается спорной [14]. Каким бы малым ни был размер узлов миомы — это точно такое же заболевание, и даже крошечные миоматозные узлы, случайно выявленные во время ультразвукового исследования, должны рассматриваться в качестве терапевтической мишени[15].
Консервативная терапия[править | править код]
Из лекарственных препаратов, использующихся при лечении миомы матки и её симптомов, находят применение следующие:
- Транексамовая кислота. Наиболее эффективное средство при меноррагиях, обусловленных миомой матки. Препарат препятствует разрушению тромбов, блокируя эндометриальный плазминоген. Клинические исследования показывают уменьшение менструальной кровопотери на одну треть.
- Антагонисты гонадотропин релизинг-гормона (ГнРГ). Подавляя выработку гонадотропных гормонов гипофиза, оказывают выраженный антиэстрогенный эффект и вызывают значительное уменьшение размеров узлов миомы. Поскольку эффект агонистов ГнРГ наблюдается только во время использования препаратов, а сроки их применения ограничены побочными эффектами, их используют в основном для подготовки к хирургическому удалению узлов.
Широко назначавшиеся ранее оральные контрацептивы и синтетические прогестагены в клинических исследованиях не обнаружили преимуществ в сравнении с плацебо для торможения роста миомы матки. Так, например, препарат Дюфастон®, часто назначаемый при миоме матки, не только не замедляет, но по некоторым данным ускоряет рост узлов[16].
Хирургическое лечение[править | править код]
До недавнего времени гистерэктомия была единственным методом лечения симптомной миомы. В настоящее время гистерэктомия применяется все реже, уступая место более современным, малотравматичным и высокоэффективным методам[10]. Из эндоскопических методов для удаления подбрюшинных узлов миомы используются лапароскопия, а для удаления подслизистых узлов — гистероскопия.
Эмболизация маточных артерий[править | править код]
Современный метод лечения миомы матки, принцип которого состоит в прекращении кровотока по маточным артериям, и замещении узлов миомы соединительной тканью[17]. Метод заключается в проведении катетера через бедренную артерию в маточную артерию и блокировании в ней кровотока с помощью эмболизационного материала. Процедура выполняется в рентгеноперационной, относится к малоинвазивным вмешательствам и не требует наркоза. Как правило, необходима госпитализация на один день. В настоящее время эмболизация все шире применяется для лечения миомы матки.
ФУЗ-абляция миомы[править | править код]
Метод лечения миомы, основанный на нагревании тканей узлов высокоинтенсивым фокусированным ультразвуком, благодаря передаче большого количества энергии в четко локализованный участок после применения которого наступает деструкция ткани узла — термический некроз. Принцип действия очень напоминает концентрацию солнечных лучей увеличительным стеклом. Вершиной развития метода является на сегодняшний день комбинация источника фокусированного ультразвука (излучатель вмонтированный в стол) и аппарата МРТ. Проведение ультразвука осуществляется через переднюю брюшную стенку. МР томограф контролирует локализацию и что особенно важно температуру нагрева в режиме реального времени. Метод позволяет проводить деструкцию четко ограниченного участка, не повреждая здоровые ткани. Зона между «пролеченной» и здоровой тканью составляет всего лишь несколько рядов клеток. Таким образом фокусированный ультразвук на сегодняшний день как никогда близко приблизился к понятию «идеальный хирургический инструмент» Процедура не требует введения инструментов в полости тела, обезболивания и госпитализации, однако возможна далеко не во всех случаях и требует правильного отбора пациентов. Субстратом для воздействия фокусированного ультразвука является соединительная ткань расположенная в миоме. Соединительная ткань хорошо накапливает энергию и позволяет достичь температуру необходимую для термического некроза. Таким образом очень хорошо лечению методом ФУЗ поддаются так называемые фибромиомы, которые составляют 70% всех миом. Лейомиомы, или клеточные миомы абсолютно не подходят к лечению методом ФУЗ из-за отсутствия субстрата для воздействия и высокоинтенсивному кровоснабжению, что не позволяет провести достаточный нагрев ткани. В период тестирования метода и его внедрения в клиническую практику неправильный отбор пациенток служил причиной частых рецидивов и ошибочно трактовался как неэффективность метода. Для оценки возможности проведения ФУЗ абляции пациентки необходимо пройти МРТ при которой определяется тип миомы. В последнее время многочисленными работами различных авторов [18], основанными на ретроспективных исследованиях пролеченных пациенток, показана высокая эффективность метода, не уступающая по показателям другим методам лечения миомы матки при условии его правильного применения[19][20][21].
Показаниями к применению ФУЗ-абляции в отношении миомы матки являются стандартные показания к органосберегающему лечению при миоме матки. В зависимости от клинических задач, которые ставит врач-гинеколог, применение технологии возможно в четырех тактических вариантах.
1. Органосберегающее лечение миомы матки.
2. Профилактика клинических проявлений миомы матки (что позволяет отказаться от выжидательной амбулаторной практики в отношении роста миоматозных узлов).
3. Подготовка узла миомы к трансцервикальной миомэктомии (в результате FUS-деструкции уменьшаются размеры узла и интенсивность кровотока, что существенно снижает риск возможных осложнений и облегчает проведение операции);
4. С целью отсрочить оперативное лечение.
В отличие от других методов, ФУЗ-МРТ абляция миомы матки — это неинвазивный, органосберегающий метод, без госпитализации, без боли, сохраняет женщине максимально высокие шансы в сравнении с другими методами на успешную беременность, имеет минимальный процент осложнений среди всех используемых методов лечения миомы матки (в настоящее время менее 0,05%).
Метод получил признание во многих странах CE (Европа), FDA (США), MHLW (Japan), CFDA (China), ANVISA (Brazil), Canada FDA, KFDA (Korea), РФ, Тайвань.
Другие виды лечения[править | править код]
Для лечения миомы используются экстракты лекарственных растений и гомеопатические препараты, однако эффективность их не является доказанной.
Профилактика[править | править код]
Специальных мер предупреждения миомы матки не существует.
Примечания[править | править код]
- ↑ 1 2 3 4 Буянова С. Н., Мгелиашвили М. В., Петракова С. А. Современные представления об этиологии, патогенезе и морфогенезе миомы матки //Российский вестник акушера-гинеколога.–2008.–Т. – 2008. – Т. 8. – С. 45-51. (недоступная ссылка)
- ↑ Сидорова И.С. Миома матки (современные аспекты этиологии, патогенеза, классификации и профилактики). В кн.: Миома матки. Под ред. И.С. Сидоровой. М: МИА 2003; 5—66.
- ↑ Мериакри А.В. Эпидемиология и патогенез миомы матки. Сиб мед журн 1998; 2: 8—13.
- ↑ Савицкий Г. А. и др. Локальная гормонемия матки и рецепторы стероидных гормонов //Акушерство и гинекология. – 1985. – №. 2. – С. 19-22.
- ↑ Вихляева Е. М., Савицкий Г. А. Миома матки. Патогенетические и терапевтические аспекты //Акуш. и гин. – 1996. – №. 6. – С. 56.
- ↑ Савицкий Г. А., Иванова Р. Д., Свечникова Ф. А. Роль локальной гипергормонемии в патогенезе темпа прироста массы опухолевых узлов при миоме матки //Акушерство и гинекология. – 1983. – Т. 4. – С. 13-16.
- ↑ Ланчинский В.И., Ищенко А.И. Современные представления об этиологии и патогенезе миомы матки. Вопр гин акуш и перинат 2003; 2: 5—6: 64—69.
- ↑ Вихляева Е.М. Руководство по диагностике и лечению лейомиомы матки. М: МЕДпресс-информ 2004; 400.
- ↑ Рыжова О.О. Патогенетические аспекты роста миоматозных узлов. В кн.: Миома матки. Под ред. И.С. Сидоровой. М: МИА 2002: 98—112.
- ↑ 1 2 Капранов С. А. и др. Новый органосохраняющий метод лечения миомы матки-эмболизация маточных артерий //Лечебное дело. – 2005. – №. 2.
- ↑ Лубнин Д. М., Тихомиров А. Л. Селективная эмболизация маточных артерий в алгоритме органосохраняющего лечения миомы матки : дис. – Москва : [Моск. гос. медико-стоматол. ун-т МЗ РФ], 2005.
- ↑ Медведев М. В., Лютая Е. Д. Миома матки //Допплерография в гинекологии: Энциклопедия ультразвуковой диагностики в акушерстве и гинекологии./Под ред. Зыкина БИ, Медведева МВМ; Реальное время. – 2000. – С. 45-58. (недоступная ссылка)
- ↑ Srividhya Sankaran, Isaac T. Manyonda. Medical management of fibroids. Best Practice & Research Clinical Obstetrics and Gynaecology Vol. 22, No. 4, pp. 655–676, 2008 doi:10.1016/j.bpobgyn.2008.03.001
- ↑ Петракова С. А., Буянова С. Н., Мгелиашвили М. В. Возможности миомэктомии в коррекции репродуктивного здоровья женщин с миомой матки //Российский вестник акушера гинеколога. – 2009. – №. 1. – С. 30-34. (недоступная ссылка). Дата обращения 16 июля 2014. Архивировано 25 июля 2014 года.
- ↑ Андроутопулос Г., Декавалас Г. Последние достижения в лечении миомы матки (недоступная ссылка). Перевод с англ. Н. Д. Фирсовой (2018).
- ↑ Тихомиров А. Д., Лубнин Д. М. Миома матки. Архивная копия от 24 мая 2018 на Wayback Machine 2006, ISBN 5-89481-417-0
- ↑ Б. Ю. Бобров, С. А. Капранов, В. Г. Бреусенко и др. Эмболизация маточных артерий: современный взгляд на проблему. «Диагностическая и интервенционная радиология» том 1 № 2 / 2007
- ↑ Incidence of Additional Treatments in Women Treated with MR-Guided Focused US for Symptomatic Uterine Fibroids: Review of 138 Patients with an Average Follow-up of 2.8 Years Krzysztof R. Gorny, PhD, Bijan J. Borah, PhD, Douglas L. Brown, MD, David A. Woodrum, MD, PhD, Elizabeth A. Stewart, MD, and Gina K. Hesley, MD
- ↑ Gorny KR, Woodrum DA, Brown DL, et al. Magnetic resonance-guided focused ultrasound of uterine leiomyomas: review of a 12-month outcome of 130 clinical patients. J Vasc Interv Radiol 2011; 22:857–864
- ↑ Park Min J, Kim Y, Rhim H, et al. Safety and therapeutic efficacy of complete or near-complete ablation of symptomatic uterine fibroid tumors by MR imaging-guided high intensity focused US therapy. J Vasc Interv Radiol 2014; 25:231–239
- ↑ Лечение больных с миомой матки фокусированным ультразвуком под контролем магнитно-резонанской томографии: клиническая безопасность, возможные осложнения Курашвили Ю.Б, Г.Е Саламандина, Чмыр Е.Н.,О.И. Батаршина., РОССИЙСКИЙ ВЕСТНИК АКУШЕРА-ГИНЕКОЛОГА 2, 2010 стр. 56-60
Ссылки[править | править код]
- Комплексная консервативная терапия миомы матки в сочетании с аденомиозом: применение препарата «Курантил» Consilium medicum
- Патология эндометрия при наличии миомы матки Consilium medicum
- Неоперативные методы лечения миомы матки Медицинский журнал Лечащий врач
Источник
Статье посвящена безоперационному лечению миомы матки. Представлены результаты исследования по оценке эффективности препарата Гинестрил при лечении симптомной миомы матки. Показано, что клиническая эффективность и хорошая переносимость препарата Гинестрил позволяют успешно использовать его при лечении миомы матки у женщин репродуктивного возраста.
Миома матки – одна из наиболее распространенных доброкачественных опухолей женской половой сферы, которая возникает у 20–40% женщин репродуктивного возраста [1–3]. У пациенток детородного возраста в структуре гинекологической заболеваемости миома матки занимает одно из ведущих мест. Несмотря на совершенствование методов профилактики, диагностики и лечения, частота встречаемости данной патологии не только не снижается, но и отмечается тенденция к ее неуклонному росту (E. Tamawa et al., 2011). Данная доброкачественная гормонально зависимая опухоль требует преимущественно радикального лечения, в связи с чем по поводу миомы матки выполняется до 50–70% оперативных вмешательств в гинекологических стационарах [1, 4, 5].
Однако, по данным зарубежной и отечественной литературы, у 50% пациенток в ближайшие и отдаленные сроки после оперативного вмешательства существенно ухудшается качество жизни, появляются психоэмоциональные, нейроэндокринные и соматические нарушения. Резко возрастает дефицит половых стероидов (прежде всего, эстрогенов), что способствует системным изменениям в органах и тканях, дефицит андрогенов усугубляет клиническую картину. Такие же изменения возникают в 30% случаев у пациенток после гистерэктомии с сохранением придатков с одной или с обеих сторон [6–8]. Развитие подобной симптоматики связано со снижением функции яичников из-за нарушения анатомии, иннервации и кровоснабжения [6, 8].
В вопросе реабилитации пациенток после гинекологических операций наиболее значимой является проблема отдаленных результатов гистерэктомии [8]. Если больной миомой матки не показано оперативное лечение, то необходимо рассмотреть вопрос об альтернативных методах. На сегодняшний день активно обсуждается вопрос профилактики развития и консервативного лечения миомы матки, что в некоторой степени может уменьшить число хирургических вмешательств.
Учитывая, что определенную роль в развитии миомы матки играют эстрогены и различные изоформы прогестерона в сочетании с повышенным содержанием митогенных факторов роста, гормональной терапии отведено ведущее место в консервативном лечении данного заболевания [1, 9–11].
В литературе есть мнение, что при бессимптомном течении миом, за исключением миом больших размеров (более 5 см), нет оснований для назначения лекарственных средств [1, 4]. По данным других авторов, выжидательная тактика при бессимптомном течении миомы матки и небольших размерах недопустима, т.к. в последующем это может привести к оперативному лечению [12, 13].
Согласно рекомендациям Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), агонисты гонадотропин-рилизинг-гормона признаны единственным лекарственным средством, способным не только уменьшить симптоматику, обусловленную миомой матки, но и временно воздействовать на объем миоматозных узлов. Однако продолжительность лечения ограничена сроком 6 мес. в связи с риском побочных эффектов. После отмены препарата через 2–3 мес. объемы миоматозных узлов приближаются к исходным параметрам [1, 14].
В настоящее время для лечения миомы матки используется улипристала ацетат, который влияет на размер миоматозного узла, не оказывая при этом побочных гипоэстрогенных эффектов [1, 15].
Мы представляем опыт медикаментозного лечения миомы матки синтетическим стероидным препаратом, конкурентным ингибитором прогестерона – мифепристоном (Гинестрил®). Клинический эффект его обусловлен блокированием действия прогестерона на уровне рецепторов. Препарат является также антагонистом андрогенов и глюкокортикоидов. В настоящее время используется в качестве монотерапии у больных миомой матки. Одной из важнейших особенностей действия Гинестрила является отсутствие гипоэстрогении, поэтому не наблюдается ни вазомоторных симптомов, ни снижения минеральной плотности костной ткани. Рекомендуемая доза для лечения миомы матки – 50 мг/сут.
Цель исследования: oценить эффективность препарата Гинестрил® в дозе 50 мг/сут при лечении симптомной миомы матки размером до 12 нед. условной беременности.
Материал и методы
B ходе оценки эффективности препарата на базе гинекологического отделения Городской клинической больницы № 1 им. Н.И. Пирогова (Москва) было проведено комплексное клинико-лабораторное обследование и лечение 60 больных миомой матки.
Критерий отбора в исследование – наличие симптомной миомы матки до 12 нед. условной беременности.
Из исследования исключались больные: в возрасте более 45 лет; с миомой матки с узлами 0-го типа субсерозной и субмукозной локализации; полипами эндометрия, атипической гиперплазией и раком тела матки; опухолями яичников и молочных желез; подозрением на саркому матки; острыми воспалительными заболеваниями органов малого таза; тяжелой соматической патологией; размерами матки более 12 нед. условной беременности; аллергическими реакциями на мифепристон; беременностью; в периоде лактации.
В процессе комплексного обследования, кроме клинико-анамнестических методов, использовались инструментальные и лабораторные методы.
Эхографическое исследование органов малого таза. Ультразвуковое исследование (УЗИ) выполнялось с ультразвуковым триплексным ангиосканированием сосудов малого таза с определением скорости кровотока по маточным, яичниковым артериям и их ветвям. Исследование выполнялось на аппарате Ultramarc-8 фирмы ATL (США), снабженном секторальным механическим датчиком с частотой 5,0, 7,5 и 10 МГц, и аппарате Acuson 128/XP-10 фирмы Acuson (США) с мультичастотным секторным датчиком 2,5–4 МГц, мультичастотным конвексным датчиком 2,5–3,5 МГц и линейным датчиком 5,0 и 7,0 МГц. УЗИ выполнено сотрудниками отделения ультразвуковой диагностики ГКБ № 1 им. Н.И. Пирогова.
Исследование гормонального профиля, включающее определение лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), эстрадиола в сыворотке крови, проводилось при помощи хемилюминесцентного метода на микрочастицах, на аппаратах Architect 2000 SR фирмы Abbott (Германия) до начала лечения, через 3 и 6 мес. после начала лечения в клинической диагностической лаборатории «Медсервис/ Диагностика».
Гистероскопия выполнялась с помощью эндоскопического оборудования фирмы Karl Storz (Германия) по стандартной методике. Для анестезиологического пособия при гистероскопии применяли внутривенный наркоз. Под контролем гистероскопии выполняли раздельное диагностическое выскабливание слизистой цервикального канала и стенок полости матки.
Препарат Гинестрил® назначался с целью уменьшения размеров матки и миоматозных узлов 30 пациенткам в возрасте от 25 до 45 лет в дозе 50 мг ежедневно перорально в течение 6 мес., лечение начиналось со второго дня менструального цикла. Средний возраст пациенток 1-й группы составил 35,0±4,27 года.
Для сравнения была выделена группа пациенток, которым с целью уменьшения размеров миомы матки назначался бусерелин инъекционно по стандартной схеме в течение 6 мес. Средний возраст пациенток 2-й группы составил 38,2±3,4 года.
Эффективность проведенной терапии оценивалась через 3 и 6 мес. в ходе лечения, через 3 и 6 мес. после окончания лечения.
При сборе анамнеза в 1-й группе 29 (96,7%) пациенток предъявляли жалобы на обильные менструации, у 12 из них менструации были болезненными и у 23 длительными (от 8 до 10 дней). При сборе анамнеза во 2-й группе 26 (86,7%) пациенток предъявляли жалобы на обильные менструации, у 8 из них менструации были болезненными и у 19 длительными (от 8 до 10 дней).
При проведении сравнительного анализа наследственности, детородной функции, гинекологического статуса, сопутствующей патологии обе группы были сопоставимы, значимых отличий не выявлено.
При УЗИ у большинства (58,6%) пациенток с миомой матки были выявлены единичные миоматозные узлы. В зависимости от локализации и характера роста 15% из них были отнесены к субсерозным узлам I типа, 27,1% – к субсерозным II типа, 18,7% – к интерстициальным и 41,1% – к субмукозным узлам II типа. Более чем у половины (53,4%) больных при изучении структуры и кровоснабжения узлов были выявлены интерстициальные и интерстициально-субсерозные миомы неоднородной эхоструктуры, повышенной эхогенности с преобладанием периферической васкуляризации над центральной. В 31,9% случаев было установлено наличие гипоэхогенных узлов с неоднородной эхоструктурой и смешанной васкуляризацией, в большинстве случаев – субмукозных II типа. Еще один тип узлов – изоэхогенные с однородной эхоструктурой и смешанным типом васкуляризации – относились преимущественно к интерстициальной локализации.
Учитывая наличие нарушений менструальной функции, до начала проведения терапии 19 (63,3%) пациенткам проводилось раздельное диагностическое выскабливание под контролем гистероскопии. По данным морфологического исследования нарушений выявлено не было, и исследование было продолжено.
Результаты исследования
По итогам лабораторных исследований до начала лечения было установлено достоверное снижение основных показателей общеклинического анализа крови по сравнению с нормативными показателями, динамика уровня гемоглобина отображена на рисунке 1. По данным клинического анализа крови установлено достоверное снижение частоты анемии.
Данные литературы указывают на важную роль нарушений гормонального гомеостаза в патогенезе пролиферативных заболеваний [16, 17]. Однако в нашем исследовании у пациенток до лечения средние показатели ЛГ, ФСГ, эстрадиола находились в пределах референсных значений, установленных для репродуктивного возраста, и не имели достоверных различий. На фоне лечения мифепристоном и спустя 6 мес. после лечения значимых отличий не было. При применении бусерелина отмечалось закономерное достоверное повышение уровней ФСГ и ЛГ и достоверное снижение уровня эстрадиола до уровней, характерных для постменопаузального периода, с чем и были связаны побочные эффекты у пациенток 2-й группы. Однако через 6 мес. после лечения все показатели значимо не отличались от показателей, имевшихся до лечения (табл. 1).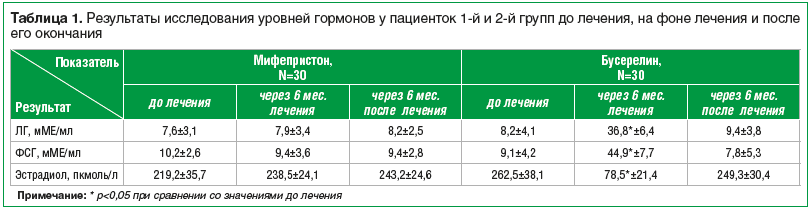
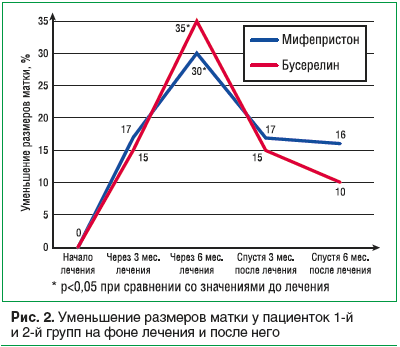
При изучении динамики изменений размеров матки в процессе лечения и после него отмечено уменьшение объема матки у пациенток 1-й группы на 30%, у пациенток 2-й группы на 35%, т. е. на фоне лечения бусерелином отмечается более выраженное уменьшение объема матки. Однако через 6 мес. после лечения объем матки увеличился, причем при использовании бусерелина более значимо (рис. 2).
У пациенток 1-й группы в процессе лечения и после него отмечено уменьшение объема матки в 1,2 раза через 3 мес. терапии, в 1,4 раза через 6 мес. Через 6 мес. после окончания лечения отмечалось незначительное увеличение объема матки, но при сравнении с исходными данными размеры матки были в 1,2 раза меньше. У пациенток 2-й группы в процессе лечения и после него отмечено уменьшение объема матки в 1,18 раза через 3 мес. терапии, в 1,5 раза через 6 мес. Через 6 мес. после окончания лечения отмечалось увеличение объема матки, но при сравнении с исходными данными размеры матки были в 1,1 раза меньше.
То есть при применении Гинестрила отмечается чуть менее выраженное уменьшение объема матки, чем при применении бусерелина (без статистически достоверной разницы между группами пациенток), но эффект после лечения сохраняется дольше (рис. 2).
В процессе лечения препаратом Гинестрил® отмечалось значительное увеличение толщины эндометрия на фоне аменореи в отличие от 2-й группы, где на фоне лечения отмечалось значительное уменьшение М-эхо. Так, через 3 мес. терапии у пациенток 1-й группы М-эхо увеличилось в 1,4 раза, через 6 мес. – в 1,9 раза, через 3 мес. после окончания терапии средняя величина М-эхо была меньше в 1,16 раза по сравнению с исходными значениями (табл. 2).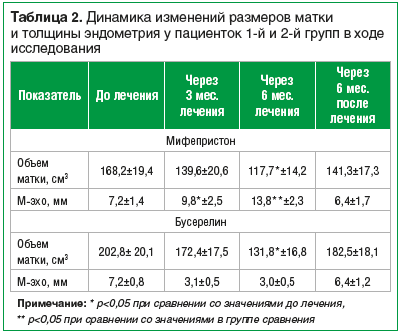
На фоне применения препарата Гинестрил®, помимо увеличения толщины эндометрия, отмечалось изменение его структуры: неоднородность, множественные анэхогенные включения.
Учитывая данные УЗИ органов малого таза, в связи с подозрением на гиперплазию эндометрия в ходе исследования 11 (36,7%) пациенткам 1-й группы проводилось раздельное диагностическое выскабливание под контролем гистероскопии. По данным гистологического исследования отмечался пролиферативный эндометрий с кистозным расширением желез, что не является морфологической картиной железистой гиперплазии эндометрия.
Учитывая результаты гистологического исследования (отсутствие гиперплазии эндометрия), от проведения раздельного диагностического выскабливания под контролем гистероскопии в дальнейшем отказались.
Сразу после отмены препарата пациентки 1-й группы отмечали обильную и продолжительную первую после проведенного курса лечения менструацию. При УЗИ органов малого таза после прекращения кровяных выделений патологии не выявлено, толщина эндометрия соответствовала ранней пролиферативной фазе. В дальнейшем нарушений менструальной функции не отмечалось.
Выводы
Сравнительный анализ эффективности применения препаратов мифепристона и бусерелина показал преимущество препарата Гинестрил® (мифепристон) при лечении симптомной миомы матки у женщин. Изучение динамики изменений размеров матки в процессе лечения мифепристоном и бусерелином и после лечения показало достоверно значимое уменьшение размера матки по обоим препаратам, однако эффект после лечения Гинестрилом сохранялся дольше.
Клиническая эффективность и хорошая переносимость препарата Гинестрил® позволяют успешно использовать его при лечении миомы матки у женщин репродуктивного возраста.
Источник