Генетические маркеры миомы матки
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ
ГЛАВА 1. Обзор литературы
1.1. Основные направления исследований генетики
мультифакториальных заболеваний
1.2. Молекулярные механизмы развития миомы матки
1.3. Молекулярно-генетические исследования миомы матки
ГЛАВА 2. Материалы и методы исследования
2.1. Клиническая характеристика обследованных групп.
2.2. Молекулярно-генетические методы
2.3. Биометрические и генетико-статистические методы
ГЛАВА 3. Изучение ассоциаций генетических полиморфизмов факторов некроза опухоли и их рецепторов с формированием миомы матки
3.1. Популяционно-генетический анализ молекулярногенетических маркеров
3.21 . Исследование роли полиморфных маркеров в развитии
• миомы матки, сочетающейся с аденомиозом
3.3. Анализ.связей генетических:маркеров с формированием
миомы матки, сочетающейся с гиперпластическими процессами эндометрия
3.4. Генетические полиморфизмы и гормональный статус
больных миомой матки
ГЛАВА 4. Исследование взаимосвязей полиморфных маркеров генов факторов некроза опухоли и их рецепторов
с характером поражения матки миоматозными узлами
4.1. Ассоциации генетических полиморфизмов с размерами миоматозных узлов
4.2. Генетические маркеры и количество миоматозных узлов
у больных миомой матки
4.3 Анализ роли наследственной отягощенности в характере взаимосвязей молекулярно-генетических маркеров с размерами миоматозных узлов
4.4 Изучение особенностей ассоциаций генетических полиморфизмов с характером поражения матки в зависимости от локализации узлов
ОБСУЖДЕНИЕ
ВЫВОДЫ
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
СПИСОК ЛИТЕРАТУРЫ
ПРИЛОЖЕНИЕ
ВВЕДЕНИЕ
Актуальность проблемы. Миома матки — это доброкачественная опухоль, растущая из незрелых миоцитов сосудистой стенки матки (Сидорова- И;С.,2003). Занимает первое место среди доброкачественных опухолей половых органов, при этом каждая десятая гинекологическая больная страдает миомой матки (Gomall A.S. et al., 2000, Нарзулаева E.H. и соавт.,2003). По поводу миомы матки выполняется до 50-70% оперативных вмешательств в гинекологических стационарах, из которых 60,9-95,5% приходится на радикальные операции, в том числе и в репродуктивном возрасте (24-26,8%) еще у совсем юных женщин, не успевших реализовать свою репродуктивную функцию (Сидорова И.С., Унанян А.Л. и др., 2007).
Проблема изучения этиопатогенеза миомы матки и факторов его определяющих продолжает оставаться в центре внимания .отечественных, и зарубежных исследователей (Сидорова И.С., 2002′,. Савицкий-Г.А. и-др., 2003,. Тихомиров А. Л. и др., 2006, Fujimoto, J; et al.,.2000, Rein-MiS. et al.,2000, Hisaoka M. et al., 2002, Olovsson Ml et al.,2005): Несмотря на. значительный прогресс, сделанный в последние ‘ десятилетия? в: этом-направлении (Karube-Harada А*.‘ et al.,2001, Asghar Т. et al.,2004) и-многочисленные гипотезы, объясняющие1 возникновение и течение миомы матки, ряд ключевых положений генеза этого заболевания до настоящего времени, остаются дискуссионными и недостаточно изученными, что затрудняет разработку новых органосохраняющих методов лечения данной патологии (Flake G.P. et al., 2003).
В последнее время накапливается все больше данных, свидетельствующих о том, что полиморфизм ряда генов имеет важное значение в формировании предрасположенности к повышенному риску развития миомы матки (Kurachr О. et al., 2001, Кулагина Н.В., 2008). Согласно материалам работы William H. et аГ., опубликованной в 2007 г в журнале « Fertility and Sterility», в формировании миомы может быть задействовано более чем 100 генов, многие из которых ’ участвуют в
ГЛАВА 2.МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1. Клиническая характеристика обследованных групп
Проведен анализ результатов наблюдений 397 человек: 240 пациенток с миомой матки и 157 женщин популяционного контроля.
Формирование выборок больных и популяционного контроля осуществлялось сплошным методом. В них включались индивидуумы русской национальности, являющиеся уроженцами Центрального Черноземья России и не имеющие родства между собой. Пациентки включались в соответствующую группу больных только после установления диагноза заболевания, подтвержденного с помощью клинических и лабораторно-инструментальных методов обследования. Клиниколабораторное обследование больных проводилось на базе гинекологического отделения перинатального центра Белгородской областной клинической больницы Святителя Иоасафа (руководитель — профессор В.Ф.Куликовский). Средний возраст больных миомой матки составил 43,6 ±7,1 лет (варьировал от 24 лет до 67 лет). Возрастная характеристика обследованных больных представлена в таблице 1. Как видно из таблицы в активном репродуктивном возрасте (24 — 40 лет) находились 66 (27,50%) женщин.
Таблица
Распределение больных миомой матки по возрастным группам
Возраст Количество, и (%)
24 — 29 лет 10(4,17%)
30 — 35 лет 29 (12,08%) •
36 — 40 лет 27(11,25%)
41 — 45 лет 64 (26,66%)
46 — 50 лет 68 (28,33%)
51 и > лет 42 (17,5%)
Обратите внимание, представленные выше научные тексты размещены для ознакомления и получены посредством распознавания оригинальных текстов диссертаций (OCR). В связи с чем, в них могут содержаться ошибки, связанные с несовершенством алгоритмов распознавания. В PDF файлах диссертаций и авторефератов, которые мы доставляем, подобных ошибок нет.
Источник
ИЗМЕНЕНИЕ ЭКСПРЕССИИ МИКРО-РНК HSA-MIR-5096 И HSA-MIR-5585 В ТКАНЯХ МИОМЫ МАТКИ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Бутенко Е.В.
1
Матевосян М.С.
1
Покудина И.О.
1
1 ФГАОУ ВПО «Южный федеральный университет»
Проведен анализ экспрессии зрелых микро-РНК hsa-miR-5096 и hsa-miR-5585 в тканях миометрия матки человека в норме и в миоматозных узлах. Исследовали парные образцы опухолевой и нормальной ткани, полученные от 15 женщин. Уровень экспрессии оценивали методом полимеразной цепной реакции в реальном времени. Исследование показало, что микро-РНК miR-5096 и miR-5585 экспрессируются в тканях миометрия как в норме, так и в миоматозных узлах. Сравнение средних значений экспрессии miR-5096 и miR-5585, нормализованной по miR-92a, в норме и при патологии не показало статистически значимых отличий. Но при сопоставлении интенсивности экспрессии miR-5096 и miR-5585 в миомном узле и в близлежащих нормальных тканях миометрия матки у конкретных пациенток методом 2-∆∆Сt в 40% случаев было выявлено снижение, а в 47% случаев повышение уровня экспрессии. Таким образом, микро-РНК 5096 и 5585 участвуют в процессах развития миомы матки. Точные молекулярные механизмы влияния микро-РНК 5096 и 5585 опосредованной регуляции экспрессии генов при формировании доброкачественных опухолей, в частности миомы матки, предстоит выяснить в дальнейших исследованиях.
микро-рнк
mir-5096
mir-5585
экспрессия
миома
1. Алтухова О.Б. Изучение молекулярно-генетических маркеров, ассоциированных с миомой матки: автореф. дис. … канд. мед. наук. – Москва, 2010. – 18 с.
2. Бутенко Е.В. Изучение некодирующих участков генома вокруг генов супрессоров опухолей / Бутенко Е.В., Романов Д.Е., Пшеничный Е.А., Машкина Е.В. // Тезисы VII съезда Российского общества медицинских генетиков, г. Санкт-Петербург, 19-23 мая 2015 г. // Медицинская генетика. – 2015. – № 2. – С. 32.
3. Романов Д.Е. ALU-элементы как предполагаемый источник сайтов микро-РНК в геноме человека // Материалы VI Международной научно-практической конференции «Актуальные проблемы биологии, нанотехнологий и медицины». — Ростов н/Д.: Издательство ЮФУ, 2015. – С. 60.
4. Стрижаков А.Н., Давыдов А.И., Лебедев В.А., Пашков В.М. Доброкачественные заболевания матки. – М.: ГЭОТАР, 2011. – 288 с.
5. Balcells I., Cirera S., Busk P.K. Specific and sensitive quantitative RT-PCR of miRNAs with DNA primers // BMC biotechnology. – 2011. – Т. 11, №. 1. – С. 1.
6. de Mooij T. et al. 336 Small RNA Sequencing of Glioblastoma Multiforme Extracellular Vesicles // Neurosurgery. – 2016. – Т. 63. – С. 198.
7. Hong X. et al. Gap junctions modulate glioma invasion by direct transfer of microRNA // Oncotarget. – 2015. – Т. 6. – №. 17. – С. 15566.
8. Ivashchenko A. et al. The Properties of Binding Sites of miR-619-5p, miR-5095, miR-5096, and miR-5585-3p in the mRNAs of Human Genes // BioMed research international. – 2014. – Т. 2014. – С. 620530.
9. Karmon A.E. et al. MicroRNAs in the development and pathobiology of uterine leiomyomata: does evidence support future strategies for clinical intervention? // Human reproduction update. – 2014. – Т. 20. – №. 5. – С. 670-687.
10. Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2− ΔΔCT method // methods. – 2001. – Т. 25. – №. 4. – С. 402-408.
11. Reshmi G., Chandra S., Babu V. Identification and analysis of novel microRNAs from fragile sites of human cervical cancer: computational and experimental approach // Genomics. – 2011. – V.97(6). – C. 333.
12. Thuringer D. et al. Transfer of functional microRNAs between glioblastoma and microvascular endothelial cells through gap junctions // Oncotarget. – 2016. – Т. 7. — № 45. – С. 73925-73934.
13. Torres A. et al. Selection and validation of endogenous controls for microRNA expression studies in endometrioid endometrial cancer tissues // Gynecologic oncology. – 2013. – Т. 130. – №. 3. – С. 588-594.
14. Tsibris J. C. M. et al. New and old regulators of uterine leiomyoma growth from screening with DNA arrays // Fertility and sterility. – 2003. – Т. 80. – № 2. – С. 279-281.
15. Zheng B. et al. The differential expression of microRNA-143,145 in endometriosis // International Journal of Reproductive BioMedicine. – 2014. – Т. 12. – №. 8. – С. 555-560.
Введение
Миома матки до настоящего времени остается серьезной проблемой репродуктивного здоровья женщин и является одной из самых распространенных доброкачественных опухолей. На ее долю приходится 15–20% в структуре гинекологических заболеваний [4]. Поиск и изучение ключевых генов является необходимым фактором для изучения генезиса, развития заболевания, нехирургической терапии и превентивных методов лечения.
Согласно работе Tsibris J.C.M. et al., опубликованной в 2003 г. в журнале «Fertility and Sterility» [14], в формировании миомы может быть задействовано более 150 генов, участвующих в процессах воспаления, регуляции клеточного роста, дифференцировки клеток, пролиферации. В конечном итоге характер роста опухоли определяется динамическим балансом между пролиферацией клеток и клеточной гибелью [1].
Микро-РНК играют важную роль в регуляции генных сетей ингибирования экспрессии мРНК вирусов, растений, животных и человека на определенных стадиях развития тканей или дифференцировки клеток и оказывают существенное влияние на экспрессию различных генов на посттранскрипционном уровне. Выявлена ключевая роль микро-РНК в нарушении баланса пролиферации, дифференцировки и программированной клеточной смерти при развитии различных заболеваний. В частности, показано, что микро-РНК способствуют развитию различных видов рака, являются весьма тканеспецифичными регуляторами онкогенеза, метастазирования рака и инвазии опухоли [15]. Показано также, что изменение экспрессии микро-РНК играет важную роль в патобиологии миомы матки посредством регуляции генов опухолевого роста. Дальнейшие исследования аномальной экспрессии микро-РНК в миоме представляют большой интерес и могут послужить основой для применения в диагностических и терапевтических целях [9].
Микро-РНК 5096 и 5585 (hsa-miR-5096, hsa-miR-5585) представляют особый интерес для изучения. Мотивы, гомологичные данным микро-РНК, а также сайтам их связывания, широко распространены в геноме человека. В ряде работ [2] было показано, что последовательности, со степенью гомологии 85% и более, распределены в межгенных и внутригенных областях генов-супрессоров опухолей, цитокинов и металлопротеиназ, генов, вовлеченных в развитие миомы матки. По всей видимости, это явление носит системный характер и, следовательно, данные микро-РНК могут быть вовлечены в процесс регуляции множества генов.
Целью данного исследования было изучение экспрессии зрелых микро-РНК miR-5096 и miR-5585 в тканях миометрия матки человека при миоме и в норме.
Материалы и методы
Выбор микро-РНК для исследования был сделан на основании результата биоинформационного анализа участков, расположенных в окрестностях 35 генов, вовлеченных в процессы пролиферации, апоптоза, воспаления и ангиогенеза, регулирующих патогенез миомы матки. Полные последовательности генов были получены из базы данных NCBI с использованием E-utilities API. Последовательности микро-РНК были получены из MiRBase realease 21. Поиск сайтов связывания был проведен при помощи комбинации программ MiRanda и GLAM2Scan. Микро-РНК регулируют гены посредством связывания с их транскриптами, при этом коэффициент связывания микро-РНК прямо пропорционален их регуляторной активности. Учитывались результаты с коэффициентом соответствия выше 95%.
Материалом для исследования послужили парные образцы миомных узлов и нормальных тканей миометрия 15 женщин в возрасте от 33 до 48 лет, средний возраст обследованных составил 37 лет. План исследования был одобрен комитетом по биоэтике Южного федерального университета, все пациенты подписали добровольное, информированное согласие на участие. Все образцы были гистологически верифицированы. Немедленно после сбора ткани были заморожены в жидком азоте и затем находились на хранении при -85 °С в биобанке Академии биологии и биотехнологии Южного федерального университета.
Для выделения тотальной РНК образцы гомогенизировали и затем использовали набор фирмы ZymoResearch, США, в соответствии с инструкцией производителя. Количество выделенной РНК и чистоту выделения оценивали спектрофотометрическим методом на приборе NanoPhotometer (Implen, Германия).
Исследование экспрессии зрелых микро-РНК 5096 и микро-РНК 5585 проводили по модифицированной методике, предложенной Baccels [5]. Нормализованные по концентрации образцы РНК полиаденилировали с использованием поли(А)полимеразы фирмы New England Biolabs (США) при 37 °С в течение 1 часа в объеме 10 мкл, затем проводили обратную транскрипцию с помощью набора «ОТ-1» («Синтол», Россия) в соответствии с инструкцией производителя. Уровень экспрессии зрелых микро-РНК оценивали с помощью количественной ПЦР в присутствии красителя SYBR-Green1, использовали готовую реакционную смесь производства «Евроген» (Россия) и праймеры, синтезированные фирмой «Синтол» (Россия), последовательности праймеров представлены в таблице 1. Образцы инкубировали в следующих условиях: один цикл при 94 °С в течение 10 с, 35 циклов – 94 °С в течение 15 с, 64 °С в течение 30 с и 72 °С в течение 30 с. Для проведения реакции использовали амплификатор BioRad CFX96 (США).
Таблица 1
Последовательности праймеров
Микро-РНК | Праймер для обратной транскрипции | Прямой и обратный праймеры для ПЦР |
hsa-miR-92а-1-5р | сag-gtc-cag-ttt-ttt-ttt-ttt-ttt-ag | gag-gtt-ggg-atc-ggt-tgg-aa agg-tcc-agt-ttt-ttt-ttt-ttt-tta-gca |
hsa-miR-5096 | cag-gtc-cag-ttt-ttt-ttt-ttt-ttt-gc | gac-ggt-ttc-acc-atg-ttg-gt gtc-cag-ttt-ttt-ttt-ttt-ttt-gcc-tg |
hsa-miR-5585 | сag-gtc-cag-ttt-ttt-ttt-ttt-ttt-ct | gca-gtg-aag-tac-cag-cta-ctc ggt-cca-gtt-ttt-ttt-ttt-ttt-tct-ctc |
Оценку результатов измерений проводили с использованием программного обеспечения, поставляемого с прибором CFX96 (BioRad). Изменение экспрессии микро-РНК определяли по соотношению концентрации исследуемой микро-РНК и внутреннего контроля (2-ΔΔ Сt) [10]. В качестве эндогенного контроля использовали микро-РНК hsa-miR-92a, выбранную в качестве референсной по данным литературы [13].
Статистическую обработку результатов проводили в программе MS Excel.
Результаты и обсуждение
Анализ результатов исследования экспрессии микро-РНК показал, что микро-РНК hsа-miR-92a и hsа-miR-5096 представлены в тканях миометрия как в норме, так и в миоматозных узлах, при этом экспрессия miR-92a оказалась достаточно стабильной. Среднее значение порогового цикла (Ct) для miR-92a в нормальном миометрии зарегистрировано на уровне 35,78±0,15, коэффициент вариации составил 0,02, в миоматозных узлах величина Ct — 35,55±0,19 при коэффициенте вариации 0,04. Экспрессия miR-5096, напротив, варьировала в широких пределах: показано, что среднее значение порогового цикла для miR-5096 в нормальном миометрии — 29,93±0,84, коэффициент вариации — 0,11. В миомных узлах значение Ct составило 29,82±0,95 при коэффициенте вариации 0,12. Результаты исследования изменения уровня экспрессии miR-5096 в здоровой ткани матки и в миоматозных узлах показаны в таблице 2.
Таблица 2
Изменение уровня экспрессии miR-5096 в нормальной ткани матки и в миоматозных узлах
Номер пациента | Уровень экспрессии в миомном узле (ΔCt) | Уровень экспрессии в тканях миометрия в норме (ΔCt) | Относительное изменение экспрессии (2-ΔΔ Сt) |
1 | -1,54 | -1,62 | 0,95 |
2 | 0,36 | -2,60 | 0,13 |
3 | -2,23 | -2,15 | 1,06 |
4 | -5,64 | -6,62 | 0,50 |
5 | -6,86 | -9,66 | 0,14 |
6 | -3,4 | -8,46 | 0,03 |
7 | -4,81 | -3,34 | 2,78 |
8 | -5,38 | -3,65 | 3,30 |
9 | -6,84 | -5,40 | 2,72 |
10 | -2,56 | -3,20 | 0,64 |
11 | -7,54 | -5,92 | 3,07 |
12 | -10,22 | -5,40 | 28,38 |
13 | -11,02 | -10,11 | 1,88 |
14 | -7,42 | -6,43 | 1,99 |
15 | -10,82 | -13,16 | 0,20 |
Сравнение средних значений экспрессии miR-5096, нормализованной по miR-92a, в норме и при патологии не обнаружило статистически значимых отличий. Но при сопоставлении интенсивности экспрессии miR-5096 в миомном узле и в близлежащих нормальных тканях миометрия матки у конкретных пациенток методом 2-ΔΔ Сt было выявлено резкое изменение количества транскриптов miR-5096. Только у двух пациенток из 15 (13%) не наблюдалось изменения экспрессии mir-5096. В 40% случаев зарегистрировано снижение, а в 47% случаев повышение уровня экспрессии.
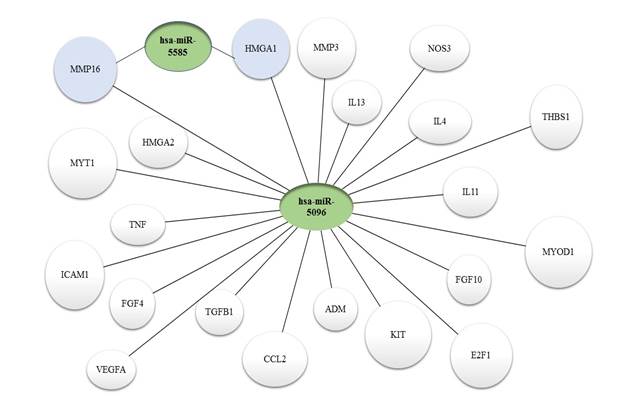
По данным современной научной литературы, в патогенезе миомы матки принимают участие множество генов, в том числе изученные в данной работе гены апоптоза (E2F1, CYR61, FGF10, CTGF, FGF19, MYC, IL11), пролиферации (MYT1, HMGA2, CDK9, MYOD1, HMGA1), ангиогенеза (ADM, FGF7, FGF3, VEGFA, NOS3, KIT, THBS1) и воспаления (IL17A, TNF, CCL2, IL15, ICAM1, TGFB1, FGF4, MMP16, CXCL8, MMP15, IL13, MMP10, IL4, IL6, MMP26). Биоинформационный поиск выявил последовательности, гомологичные микро-РНК hsа-miR-5096 внутри 22 генов, и последовательности, гомологичные hsa-miR-5585 внутри 2 генов из 35 исследованных. Хотя вопрос о функциональности обнаруженных сайтов связывания остается открытым, их наличие и высокая степень гомологии позволяют предположить роль микро-РНК 5096 и 5585 в регуляции работы потенциальных генов-мишеней. Результаты биоинформационного анализа представлены на рисунке.

Потенциальные гены-мишени микро-РНК miR-5096 и miR-5585 по данным биоинформационного исследования
Микро-РНК 5096 была открыта сравнительно недавно, и ее функции практически не изучены. Ген микро-РНК miR-5096 локализован на хромосоме 4 и располагается внутри интрона гена BMP2. Последовательность зрелой miR-5096 состоит из 21 нуклеотида и биоинформационно предсказанные сайты ее связывания располагаются на 832 таргетных матричных РНК. Предполагается, что такое большое количество сайтов связывания указывает на функциональную роль miR-5096 в качестве координатора экспрессии больших генных ансамблей [8]. Источником мотивов, гомологичных miR-5096, в геноме человека служат Alu-элементы [3]. В исследованиях экспрессии miR-5096 при раке шейки матки и глиоме было показано, что экспрессия при раке шейки матки не изменяется [11]. В клетках глиомы экспрессия miR-5096 возрастала по сравнению с нормальной тканью мозга, при этом перенос miR-5096 из клеток глиомы в астроциты увеличивал способность опухоли к инвазии [7]. Микро-РНК 5096 способна мигрировать из опухолевых клеток в клетки эндотелия сосудов, в которых служит в качестве индуктора ангиогенеза. Перенос miR-5096 из клетки в клетку происходит через щелевые межклеточные контакты [12]. В нашей работе впервые показано изменение экспрессии miR-5096 в миомных узлах по сравнению с нормальными тканями миометрия матки у человека.
Экспрессия miR-5585 также варьировала в широких пределах, среднее значение порогового цикла для miR-5585 в нормальном миометрии составило 32,07±1,03 при коэффициенте вариации 0,12, в миомных узлах значение Ct оказалось 31,08±1,27 при коэффициенте вариации 0,16. Сравнение средних значений экспрессии miR-5585, нормализованной по miR-92a, в норме и при патологии не выявило статистически значимых отличий. Но при сопоставлении интенсивности экспрессии miR-5585 в миомном узле и в близлежащих нормальных тканях миометрия матки у конкретных пациенток методом 2-ΔΔ Сt было обнаружено значительное изменение количества транскриптов miR-5585. Изменения в экспрессии, так же как и в случае микро-РНК 5096, были разнонаправленными, в 53% образцов наблюдалось снижение, а в 47% — увеличение ее уровня. Результаты исследований представлены в таблице 3.
Таблица 3
Изменение уровня экспрессии miR-5585 в нормальной ткани матки и в миоматозных узлах
Номер пациента | Уровень экспрессии в миомном узле (ΔCt) | Уровень экспрессии тканях миометрия в норме (ΔCt) | Относительное изменение экспрессии (2-ΔΔ Сt) |
1 | -1,91 | -1,05 | 1,81 |
2 | -0,16 | -3,01 | 0,14 |
3 | -1,40 | -2,30 | 0,54 |
4 | -0,80 | -1,49 | 0,62 |
5 | -2,52 | -2,65 | 0,91 |
6 | -1,89 | -1,10 | 1,73 |
7 | -2,45 | -0,12 | 5,02 |
8 | -3,83 | -0,18 | 12,50 |
9 | -2,02 | -1,35 | 1,59 |
10 | -2,36 | -2,93 | 0,68 |
11 | -7,73 | -9,61 | 0,27 |
12 | -6,52 | -5,63 | 1,85 |
13 | -12,03 | -6,54 | 45,05 |
14 | -7,32 | -7,88 | 0,68 |
15 | -10,93 | -11,37 | 0,73 |
Ген микро-РНК miR-5585 локализован на хромосоме 4 и располагается внутри интрона гена трансмембранного белка 39b TMEM39B. Последовательность зрелой miR-5585 состоит из 22 нуклеотидов, и биоинформационно предсказанные сайты ее связывания располагаются в 725 таргетных матричных РНК [8]. Изменение экспрессии miR-5585 показано при глиобластоме, уровень экспрессии был ассоциирован с выживаемостью. Гены-мишени большинства микро-РНК, изменяющих свою экспрессию в клетках глиомы, относились к генам клеточного цикла, а также сигнальных путей PI3K/Akt, p53 и KEGG [6].
Заключение
Накопленные данные и функциональные модельные эксперименты подтверждают концепцию влияния микро-РНК на развитие миомы матки. В результате проведенного исследования показано, что микро-РНК miR-5096 и miR-5585 экспрессируются в тканях миометрия матки как в норме, так и при лейомиоме, при этом в большинстве случаев в миоматозных узлах зарегистрировано изменение количества транскриптов miR-5096 и miR-5585 по сравнению с нормальной тканью. На основании этого, очевидно, можно сделать вывод о том, что исследованные микро-РНК участвуют в процессах патогенеза миомы матки. Точные молекулярные механизмы влияния микро-РНК miR-5096 и miR-5585 опосредованной регуляции экспрессии генов при формировании доброкачественных опухолей, в частности миомы матки, предстоит выяснить в дальнейших экспериментах, которые могут послужить основой для применения микро-РНК в клинической медицине в качестве биомаркеров и терапевтических мишеней.
Исследование выполнено на оборудовании ЦКП «Высокие технологии» ЮФУ в рамках базовой части госзадания МОН РФ по теме: «Исследование функциональной роли генетических полиморфизмов и микроРНК в геноме человека и животных», проект № 6.6762.2017/БЧ.
Библиографическая ссылка
Бутенко Е.В., Матевосян М.С., Покудина И.О. ИЗМЕНЕНИЕ ЭКСПРЕССИИ МИКРО-РНК HSA-MIR-5096 И HSA-MIR-5585 В ТКАНЯХ МИОМЫ МАТКИ // Современные проблемы науки и образования. – 2017. – № 3.;
URL: https://science-education.ru/ru/article/view?id=26389 (дата обращения: 02.02.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник


