Лимфоциты при миоме матки

ФАКТОРЫ ЛОКАЛЬНОГО ИММУНИТЕТА ПРИ РАКЕ ЭНДОМЕТРИЯ И МИОМЕ МАТКИ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Златник Е.Ю.
1
Никитин И.С.
1
Никитина В.П.
1
Новикова И.А.
1
Кравцова О.Е.
1
Бахтин А.В.
1
Селютина О.Н.
1
1 ФГБУ «Ростовский Научно-Исследовательский Онкологический Институт» Минздрава РФ
В работе проведено сравнительное исследование факторов локального клеточного иммунитета при злокачественных и доброкачественных опухолях эндометрия (раке эндометрия и миоме матки). Методом проточной цитофлюориметрии исследовали лимфоцитарный состав гомогената опухолевой и немалигнизированной ткани 45 больных, которым первым этапом лечения выполнялась операция по поводу данных заболеваний. Установлено преобладание в обеих опухолях Т-лимфоцитов над В-лимфоцитами, а CD3+CD8+ и CD3+CD4+. Полученные различия характеризовались более высокими уровнями Т-лимфоцитов (CD3+CD4+ и CD3+CD8+) в ткани рака эндометрия по сравнению как с непораженной тканью эндометрия, так и с тканью миомы, тогда как содержание NK-клеток в ткани рака эндометрия, напротив, было снижено. Отмечено доминирование влияния злокачественной опухоли, развивающейся вместе с доброкачественной у одной больной, на формирование иммунологического окружения последней
миома матки
рак эндометрия
локальный иммунитет
Т-лимфоциты
натуральные киллеры
1. Ашрафян Л.А., Киселев В.И. Опухоли репродуктивных органов (этиология и патогенез). — М.: Изд-во Дмитрейд График Групп, 2008. – 216 с.
2. Златник Е.Ю., Никипелова Е.А, Непомнящая Е.М. и др. Морфо-иммунологические параллели в раковых опухолях и аденомах толстой кишки // Росс. журн. гастроэнтерологии, гепатологии и колопроктологии. – 2014. – № 5. – С.145.
3. Златник Е.Ю., Неродо Г.А., Бахтин А.В. и др. Характеристика общего и локального клеточного иммунитета у больных раком яичника // Международный журнал экспериментального образования. Медицинские науки. – 2014. – № 1. – С. 72-75.
4. Пашов А.И., Цхай В.Б., Камзалакова Н.И. и др. Особенности иммунного статуса больных раком эндометрия в зависимости от степени дифференцировки опухоли // Вестн. НГУ им. Н.И. Лобачевского. – 2004. – Вып. 2. – С. 55–58.
5. Ткаченко Л. В., Свиридова Н. И. Современные представления об этиопатогенезе гиперпластических процессов в перименопаузе // Вестник Волгоградского государственного медицинского университета. – 2007. – № 4 (24). – С. 3-7.
6. Чиссов В. И., Старинский В. В., Петрова Г. В. Злокачественные новообразования в России в 2006 г. (Заболеваемость и смертность). – М., 2008.
7. Янченко О.С., Конторщикова Е.Ю., Шахова К.А. и др. Особенности иммунного статуса больных миомой матки и раком эндометрия // Вестн. НГУ им. Н.И. Лобачевского. – 2012. – Вып. 2–3. – С. 300–303.
8. International collaborations in cancer control and the 3rd international Cancer Control Congress. Timori Milan. – 2009. – Vol. 95. – P. 579-596.
9. Varma R. Soneja H., Bhatia K., et al. The effectiveness of a levonorgestrel-relisingintrauterinesystem (LNG – IUS) in the treatment of endometrial hyperplasia – along-term follow-up study// Eur. J. Obstet. Gynecol. Reprod. Biol. 2008. Vol. 139. P. 169–175.
10. Zheng W., Xie D., Cerhan J. R., et al. Main Biomarkers of cancer endometrium // Epidemiol Biomarkers Prev. 2001. Vol. 10. P. 89–94.
Гиперпластические процессы эндометрия
до сих пор представляют собой чрезвычайно важную и многогранную проблему
онкогинекологии. Неослабевающий интерес к ней определяется тенденцией
гиперпластических процессов эндометрия к длительному, рецидивирующему течению,
отсутствием специфических, патогномоничных симптомов, сложностью
дифференциальной диагностики и выбора методов лечения [1, 8]. Имея неодинаковую
степень развития, гиперпластические процессы нередко становятся благоприятным
фоном для возникновения предрака, а затем и рака эндометрия [5, 10].
За
последние 20 лет отмечен неуклонный рост частоты рака тела матки [6], который
занимает 4-е место среди злокачественных новообразований, встречающихся у
женщин.
В последние годы получены новые данные о патогенетических
механизмах формирования и развития рака эндометрия [1, 5, 9]; в частности,
установлена тесная взаимосвязь репродуктивной и иммунной систем. В ряде научных
исследований убедительно доказан тот факт, что состояние клеточного и
гуморального иммунитета является одним из основных факторов, определяющих
течение заболевания, в том числе рака эндометрия [4, 7]. Работы последних лет
показали, что состояние Т- и В-звеньев иммунной системы у женщин с гиперплазией
эндометрия характеризуется угнетением количества и функциональной активности
Т-клеток, тенденцией к усилению продукции сывороточных рецепторов; при атипической
гиперплазии эндометрия описана активация показателей В-клеточного иммунитета, а
изменения в системе Т-лимфоцитов оказались менее выраженными [7]. Потенциально
важную роль в формировании новообразований играют цитокины, являющиеся не
только регуляторными молекулами иммунной системы, но и посредниками
межсистемных взаимодействий, но до настоящего времени нет единого мнения о
степени их участия в патогенезе гиперпластических процессов эндометрия. Возможная
роль факторов иммунной системы в патогенезе рака эндометрия привлекает внимание
исследователей; при этом факторы локального иммунитета, присутствующие в опухоли
и прилежащей к ней ткани, остаются малоизученными, а сведения о них
немногочисленны и противоречивы.
Целью настоящего исследования
явилось изучение некоторых факторов локального иммунитета у больных раком
эндометрия и миомой матки.
Материалы и методы. В
исследование были включены 45 больных раком эндометрия (РЭ) Т1-2N0M0 (30 больных), миомой матки
(ММ, 9 больных), а
также раком эндометрия в сочетании с миомой матки (РЭ+ММ, 6 больных), которым первым этапом лечения было выполнено хирургическое вмешательство
в соответствии с существующими стандартами в отделении онкогинекологии ФГБУ
«РНИОИ» МЗ РФ. Сравнительная характеристика групп больных по возрасту и
сопутствующей патологии не выявила достоверных различий, что позволило провести
анализ результатов исследования.
Состояние локального иммунитета изучали в образцах тканей
опухоли и здоровой ткани, взятых при проведении оперативного вмешательства. Удаленные
опухоли подвергались патоморфологическому исследованию; кроме того, отдельные
фрагменты опухолевой и визуально немалигнизированной ткани, которую считали
здоровой, гомогенизировали с помощью дезагрегирующего устройства BD
Medimachine. В гомогенатах тканей определяли популяционный и субпопуляционный
состав лимфоцитов на проточном цитометре FACSCantoII (BD) с панелью антител T-,
B-, NK (CD45, CD3,
CD4, CD8, CD19,
CD16/56), результаты выражали в процентах от общего
количества лимфоцитов.
Статистическую обработку данных выполняли с
помощью параметрических и непараметрических методов (t-критерий Стьюдента, критерий
Уилкоксона, метод непрямых разностей).
Результаты исследования
Результаты
исследования представлены в табл. 1 и на рис. 1, 2.
Таблица 1
Показатели
локального клеточного иммунитета в образцах тканей больных РЭ и ММ
Образцы тканей | Субпопуляции лимфоцитов, | ||||
CD3+ | CD3+CD4+ | CD3+CD8+ | CD19+ | CD16/56+ | |
Опухоль РЭ (n=21) | 85,75±2,17* ** | 37,47±4,37* ** | 45,5±3,8 ** | 1,48±0,46 | 10,2±2,14* ** |
Опухоль ММ (n=9) | 64,24±5,66 | 23,2±3,07 | 31,5±3,5 | 1,01±0,4 | 32,84±6,12 |
Здоровая ткань больных РЭ (n=19) | 73,5±3,17 *** | 24,4±1,5 | 43,0±3,74 *** | 1,82±0,68 | 22,0±3,0 *** |
Здоровая ткань больных ММ (n=9) | 59,24±4,76 | 20,14±3,17 | 29,14±2,34 | 0,76±0,11 | 38,0±4,8 |
Примечание.
* – статистически достоверные отличия показателей опухолевой ткани РЭ от
здоровой (p<0,05); ** – статистически
достоверные отличия показателей опухолевой ткани РЭ от ММ; *** – статистически
достоверные отличия показателей здоровой ткани РЭ от ММ.
Как видно из табл.1, показатели количества лимфоцитов некоторых субпопуляций,
присутствующих в образцах опухолевой ткани, статистически достоверно отличаются
от соответствующих показателей немалигнизированной ткани. Так, процентное
содержание Т-лимфоцитов в ткани РЭ оказалось выше за счет CD3+CD4+ клеток, а
NK-лимфоцитов – ниже, чем в непораженной ткани; уровни CD3+CD8+ и В-лимфоцитов не
различаются. При проведении аналогичного анализа показателей локального
клеточного иммунитета в образцах тканей больных ММ статистически достоверных
отличий от показателей здоровой ткани не отмечено. Сопоставление факторов локального
иммунитета в ткани злокачественной и доброкачественной опухолей показало, что
содержание Т-лимфоцитов исследованных субпопуляций было статистически
достоверно выше в ткани РЭ по сравнению с тканью ММ, а содержание натуральных
киллеров, напротив, выше в ткани ММ (табл. 1). Обращает на себя внимание, что
характеристики непораженной ткани также имеют статистически значимые различия:
при РЭ в ее образцах уровни CD3+ и CD3+CD8+ лимфоцитов были выше, а уровень CD16+/56+
клеток, напротив, ниже, чем при ММ.
Ситуация
развития в одном органе двух опухолей, одна из которых злокачественная, а
другая доброкачественная, может отразиться на их лимфоцитарном микроокружении и
детализировать взаимоотношения «опухоль-организм» в таких случаях. Сравнительная
характеристика исследованных показателей в образцах тканей РЭ и ММ, развивающихся
по отдельности и вместе, представлена на рис. 1 и 2.
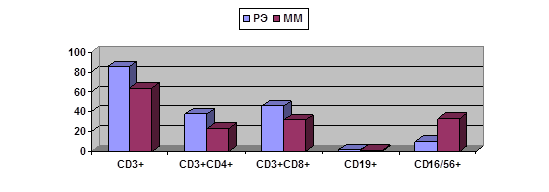
А
Б
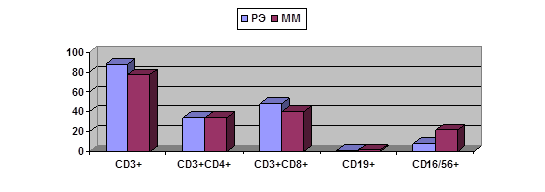
Рис. 1. Сравнительная характеристика тканевого содержания лимфоцитов
в опухолях больных РЭ и ММ при их раздельном и совместном развитии.
А – при РЭ и ММ, выявленных у разных больных;
Б – при РЭ и ММ, выявленных у одной больной
Как видно из рис. 1, при одновременном развитии злокачественной и доброкачественной
опухоли характеристики лимфоцитарного микроокружения доброкачественной опухоли
оказываются ближе к наблюдаемым при злокачественной. Так, если при ММ в
отсутствии РЭ показан ряд отличий содержания лимфоидных субпопуляций от
обнаруженных при РЭ (рис. 1А), то при одновременном наличии ММ и РЭ большинство
этих различий нивелируется (касающиеся содержания CD3+, CD3+CD4+, CD3+CD8+ клеток); статистически значимые различия сохраняются
только для NK-клеток (рис. 1Б). Возможно, это отражает
дистантное влияние злокачественной опухоли на окружение доброкачественной.
Интересно,
что непораженная ткань эндометрия у больных ММ и у больных РЭ+ММ, также имела
ряд различий по составу лимфоцитов исследованных субпопуляций (рис. 2), а
именно, в первом случае ткань содержала меньше Т- и В-лимфоцитов и больше
NK-клеток (59,24±4,76, 0,76±0,11 и 38,0±4,8% против 71,4±1,89, 2,98±0,97 и
19,4±1,4% соответственно; для всех показателей p<0,05).
Напротив, при РЭ лимфоцитарный состав как опухоли, так и немалигнизированной
ткани вне зависимости от наличия или отсутствия у больных ММ был аналогичен.
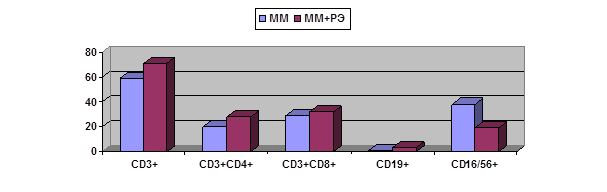
Рис. 2. Сравнительная характеристика тканевого содержания
лимфоцитов в немалигнизированной ткани при ММ в зависимости от наличия у
больной РЭ
Заключение
Таким
образом, при ММ, развивающейся вместе с РЭ, в формировании иммунологического
окружения доминирует влияние последнего, т.е. лимфоцитарный состав ткани опухоли
и близлежащей непораженной ткани менее значительно отличается от показателей,
обнаруженных при РЭ, чем при ММ в отсутствии РЭ. Нами ранее получены подобные
различия при анализе тканевого цитокинового состава в одновременно удаленных
аденоматозных полипах и аденокарциномы толстой кишки, т.е. влияние
злокачественной опухоли на спектр факторов локального иммунитета оказалось
преобладающим над доброкачественной [2].
Итак,
обнаружены черты как сходства, так и различий показателей локального иммунитета
в доброкачественных и злокачественных опухолях эндометрия. К первым относится
выраженное преобладание лимфоцитов Т-ряда над В-клетками в ткани обеих опухолей
и немалигнизированных образцов, что присуще многим тканям по сравнению с
периферической кровью [2, 3]. Вторые
определяются преимущественным накоплением CD3+CD4+ и CD3+CD8+ клеток в ткани злокачественной опухоли, а NK-лимфоцитов
– в ткани доброкачественной. Частично такие различия найдены и в непораженной
ткани, что, по нашему мнению, свидетельствует о дистантном влиянии РЭ на состав
иммунологического микроокружения, о чем также говорит приближение характеристик
последнего в ткани ММ и прилежащей к ней здоровой ткани к характеристикам,
наблюдаемым при РЭ, в случае развития обоих новообразований у одной больной. Описанные
в литературе сведения о более высоком содержании CD3+СD8+ клеток и более низком количестве NK-лимфоцитов
в крови больных ММ по сравнению с РЭ при высоком уровне В-лимфоцитов при обоих
новообразованиях [7], на наш взгляд, подтверждают особенности локального
иммунитета по сравнению с системным и необходимость их исследования для понимания
процессов взаимодействия «опухоль-организм», происходящих на органном и
тканевом уровне.
Рецензенты:
Николаева Н.В., д.м.н., ассистент кафедры
онкологии ГБОУ ВПО Ростовского государственного медицинского университета
Минздрава РФ, г. Ростов-на-Дону;
Каймакчи О.Ю., д.м.н.,
ассистент кафедры онкологии ГБОУ ВПО Ростовского
государственного медицинского университета Минздрава РФ, г. Ростов-на-Дону.
Библиографическая ссылка
Златник Е.Ю., Никитин И.С., Никитина В.П., Новикова И.А., Кравцова О.Е., Бахтин А.В., Селютина О.Н. ФАКТОРЫ ЛОКАЛЬНОГО ИММУНИТЕТА ПРИ РАКЕ ЭНДОМЕТРИЯ И МИОМЕ МАТКИ // Современные проблемы науки и образования. – 2015. – № 4.;
URL: https://science-education.ru/ru/article/view?id=20478 (дата обращения: 29.01.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Pages: | 1 | 2 |
| 4 | 5 | … | 6 |
— [ Страница 3 ] —
Количественное определение основных субпопуляций лимфоцитов периферической крови, осуществленное с помощью проточной цитометрии, показало, что относительное содержание различных популяций лимфоцитов у 46 обследованных пациенток не выходило за пределы популяционной нормы (контрольная группа, n=50) (Тотолян А.А. и соавт., 1999) (р>0,05). Сопоставление данных иммунофенотипирования лимфоцитов периферической крови у больных миомой матки в зависимости от наличия или отсутствия клинических проявлений заболевания выявило достоверное увеличение относительного содержания В-лимфоцитов (CD3–CD19+) в группе пациенток, у которых миома матки протекала с клиническими проявлениями (р=0,045). Определено значимое увеличение относительного содержания В-лимфоцитов (CD3–CD19+) (р=0,035) и натуральных киллеров (CD3–CD(16+56)+) (р=0,025) у пациенток с пролиферирующей формой миомы матки по сравнению с больными, имевшими простую форму опухоли, что позволяет предполагать активацию этих субпопуляций при множественности миоматозных узлов и ускоренном росте опухоли. Выявлена связь частоты развития меноррагий и высокого содержания Т-лимфоцитов (CD3+CD(16+56)–) (p<0,05) и Т-киллеров (CD3+CD(16+56)+) (p<0,05). По всей видимости, увеличение содержания Т-лимфоцитов является вторичным. Описанный феномен обязан своим возникновением активизации клеточного звена иммунной системы в ответ на развитие осложненной формы заболевания, а также может быть маркером инфекции, играющей роль в индукции развития миомы матки, о чем свидетельствуют данные литературы (Малышкина А.И., 2006; Тихомиров А.Л., 2006).
В то же время, при множественной миоме отмечалось повышение доли CD4+8– (р=0,004) лимфоцитов, что может служить признаком общей активации афферентного звена клеточного иммунного ответа при увеличении числа очагов и массы опухоли. Об этом же свидетельствует более высокое содержание CD4+8– (р<0,05) лимфоцитов у больных миомой матки, сопровождавшейся меноррагиями.
Таким образом, выявленные отклонения в субпопуляционном составе лимфоцитов периферической крови были наиболее выражены при течении заболевания, сопровождавшемся клиническими проявлениями: наличием меноррагий, ростом опухоли, а также при многоузловых формах миомы матки. Возникающие при развитии заболевания нарушения в относительном содержании тех или иных субпопуляций лимфоцитов являются отражением прогрессии опухолевого процесса в миометрии.
При сопоставлении результатов генетического и иммунологического исследования было обнаружено, что имеется связь между аллелями/гаплотипами промоторных аллелей генов ММР-1 и ММР-3 и представленностью субпопуляций лимфоцитов в периферической крови больных миомой матки: носительство аллеля 2G гена ММР-1 ассоциировано с увеличением относительного содержания в периферической крови натуральных киллеров CD3–(16+56)+ (р=0,03). У пациенток – носителей промоторного аллеля 1G гена ММР-1 наблюдалось увеличение относительного содержания Т-киллеров (СD3+(16+56)+) (р=0,007). Выявлена обратная корреляционная связь между аллелем 6А ММР-3 и содержанием Т-хелперов (CD4+8–) (p=0,002). Относительное содержание CD3–19+ и CD3–(16+56)+ лимфоцитов значительно повышено у пациенток – носителей гаплотипа 2G ММР-1/5А ММР-3 (p=0,01 и p=0,04, соответственно). Гаплотип 1G ММР-1/6А ММР-3 имел обратную корреляцию с относительным содержанием в периферической крови клеток CD3+(16+56)+ (p=0,01) и прямую – с содержанием CD4+8– (p=0,008).
Расселение и пролиферация лимфоидных клеток в организме тесно связаны с их способностью к миграции. В этом процессе важную роль играют активация и экспрессия матриксных металлопротеиназ. В нашем исследовании показано повышение относительного содержания в крови натуральных киллеров (NK-клеток) у больных с гиперактивным генотипом ММР-1 2G/2G. Этот результат согласуется с данными S. Goda и соавт. (2006), свидетельствующими об усилении продукции ММР-1 натуральными киллерами при их активации хемокином CXCL12, что предполагает повышенную деградацию коллагенового матрикса при индукции данного гена у больных с гиперактивным генотипом. Взаимосвязь между менее активным гаплотипом (ММР-1 1G/ММР-3 6А) и относительным содержанием CD4+ Т-клеток, обнаруженная в нашем исследовании, может быть объяснима различной динамикой программированной гибели этих клеток в организмах с разным генотипом ММР. Меньшая активность ММР (связанная, например, с менее активным вариантом 1G гена ММР-1), напротив, ассоциирована с большей интактностью Fas-лиганда и повышенными уровнями CD4+ лимфоцитов в кровотоке. С другой стороны, при деструктивно-воспалительных процессах в организме, в частности аутоиммунных заболеваниях, матриксные металопротеиназы и фрагменты их молекул могут играть роль мишеней для распознавания и привлечения Т-клеток в зоны воспаления (van Bilsen et al., 2004). В таком случае, пониженные уровни экспрессии ММР-1 (генотип 1G) или ММР-3 (генотип 6A) могут быть причиной менее выраженной миграции CD4+ лимфоцитов в ткани и их персистенцией в периферической крови.
Особенности экспрессии цитокинов в перитонеальной жидкости у больных миомой матки
Локальный иммунный ответ, изучавшийся на основании особенностей экспрессии цитокинов в перитонеальной жидкости больных миомой матки, показал, что на местном уровне иммунные изменения при опухолевом росте более выражены, чем на системном.
С целью изучения роли цитокинов, обусловливающих развитие Th1- (клеточного) либо Th2-типа (гуморального) ответа у пациентов с миомой матки, было проведено клиническое обследование 27 пациенток: 20 женщин, имевших миому матки (основная группа) и семи – не имевших миомы матки (группа сравнения), которым проводилась диагностическая лапароскопия в связи с трубной формой бесплодия.
Результаты проведенного исследования показали достоверное повышение уровня IL-10 у пациенток с миомой матки при сопоставлении с группой сравнения (р=0,016). При дальнейшей статистической обработке уровень цитокинов у пациенток с миомой матки был проанализирован в зависимости от клинических вариантов течения заболевания. Были выявлены достоверно повышенные уровни IL-10, GM-CSF, IFN- и TNF- у пациенток с длительностью течения заболевания более 5 лет по сравнению с пациентками, у которых миома матки существовала менее 5 лет (р<0,05).
Обнаружен повышенный уровень IL-10 у пациенток с растущей опухолью (р<0,05), при наличии сопутствующего миоме матки аденомиоза (р<0,05) по сравнению с группой контроля. У пациенток с размером матки, соответствовавшим величине менее 8 недель беременности, уровень IFN- был достоверно выше, чем в группе больных с размером миомы матки более 8 недель (р=0,002). Помимо этого, содержание IFN- в перитонеальной жидкости пациенток с миомой матки обратно коррелировало с размером матки (p=0,029) (рис. 2).
Результаты исследования показали повышение уровня IL-5 у пациенток с единичными миоматозными узлами (менее 5) в сопоставлении с группой больных, имевших множественные миоматозные узлы (5 и более) и группой контроля (р<0,05). Кроме того, интрамуральная и субсерозная локализация узлов также характеризовалась повышенным содержанием IL-5 в перитонеальной жидкости по сравнению с контрольной группой (р<0,05). Эозинофильная инфильтрация миометрия, возможно, сопутствующая повышенной продукции IL-5 в перитонеальной жидкости, является протективным фактором применительно к локализации и количеству миоматозных узлов у пациенток с миомой матки.

Рис. 2. Зависимость между содержанием IFN- в перитонеальной жидкости у больных миомой матки и размером матки (r= –0,50; p=0,029).
Полученные результаты выявили сдерживающую роль Th1-типа иммунного ответа в прогрессировании миомы матки. Подтверждением этому является отрицательная корреляция между размером опухоли и содержанием IFN- в перитонеальной жидкости больных. Кроме того, длительно существующий в миометрии пролиферативный процесс также вызывает активацию иммунной системы преимущественно по Th1 пути, на что указывает увеличение содержания IL-10, GM-CSF, IFN- и TNF- в перитонеальной жидкости больных миомой матки. Антигенная нагрузка в виде патологически измененного коллагена миоматозных узлов приводит к стимуляции клеточного звена иммунного ответа – это выражается в возрастании содержания NK-клеток и Т-клеток (Т-супрессоров и Т-киллеров), в активном состоянии продуцирующих IFN-. Заключение об активации клеточного типа иммунной защиты подтверждается и нашими данными, полученными при исследовании содержания субпопуляций лимфоцитов в периферической крови (системный ответ): отмечено относительное увеличение Т-хелперов и NK-клеток при развитии опухоли больших размеров и многоузловых форм миомы матки.
Вместе с тем, IFN- играет важную роль в процессах воспроизводства и функционирования экстрацеллюлярного матрикса, в частности, коллагена (Buttice G. et al., 2006). Сигнальные пути, подавляющие активность промотора коллагена, активируют IFN- (Ghosh A.K. et al., 1999). Эта закономерность свидетельствует о снижении способности организма к регуляции экспрессии коллагена по мере прогрессирования заболевания. В нашем исследовании отмечена прогностически неблагоприятная ассоциация гиперактивных аллельных вариантов гена коллагеназы ММР-1 с многоузловыми формами миомы матки, быстрым ростом опухоли. Известно, что IFN- блокирует дифференцировку фибробластов в миофибробласты, вызванную TGF- (трансформирующим фактором роста ) (Gu L. et al., 2004). Таким образом, наблюдаемая при миоме матки гиперпродукция TGF-, возможно, сдерживается эндогенно синтезируемым IFN-, что является фактором, замедляющим развитие заболевания. Очевидно, что недостаточность клеточного звена иммунного ответа является одной из предпосылок быстрого развития миомы матки. Увеличение экспрессии IL-10, отмеченное при растущей миоме, может свидетельствовать о неблагоприятной роли Th2-типа иммунного ответа в развитии опухоли.
Роль системы хемокинов в развитии различных клинических вариантов течения миомы матки
Была определена экспрессия мРНК хемокинов – эотаксина, эотаксина-2, IL-8, MIP-1, MIP-1, RANTES и хемокиновых рецепторов – ССR1, CCR3, CCR5, CXCR1, CXCR2 в ткани миоматозного узла и интактного миометрия у 24 больных с различными клиническими формами течения миомы матки.
В результате проведенного исследования было выявлено снижение экспрессии генов эотаксина (р=0,005), MIP-1 (р=0,029), MIP-1 (р=0,003) и CCR5 (р=0,034) в тканях миомы матки по сравнению с миометрием. Указанный факт можно трактовать как нарушение продукции регуляторных факторов (хемокинов и их рецепторов) в патологически измененной ткани вследствие утраты упорядоченной клеточной структуры (рис. 3).

Рис. 3. Содержание мРНК хемокинов эотаксина, MIP-1, MIP-1 и рецептора хемокина ССR5 в тканях миомы матки и миометрия. Различия достоверны при р<0,05.
При простой форме миомы матки, в отличие от пролиферирующей, в опухолевой ткани наблюдалось достоверно сниженное по сравнению с миометрием содержание MIP-1 (р=0,002), ССR5 (р=0,009) и эотаксина (р=0,004). Как показали результаты наших исследований, у пациенток с пролиферирующей формой миомы матки наблюдалось повышенное содержание NK-клеток в периферической крови по сравнению с простой формой опухоли. В связи с тем, что MIP-1 способствует привлечению в ткани матки NK-клеток (Kitaya K. et al., 2003), можно предположить, что эти события взаимосвязаны и участвуют в регуляции пролиферации при миоме матки.
Уровень экспрессии мРНК эотаксина в миометрии был выше при небольшом количестве узлов опухоли (менее 5) (р=0,046). В наших исследованиях было отмечено повышенное содержание IL-5 (фактора роста эозинофилов) в перитонеальной жидкости у пациенток с единичными узлами по сравнению с многоузловой формой миомы. Выявленные закономерности указывают на возможную протективную роль эозинофилов в клинической картине заболевания.
Установленное повышение экспрессии мРНК IL-8 в тканях лейомиомы при субмукозной локализации узлов (р=0,013) по сравнению с экспрессией при других локализациях, вероятно, характеризует вовлечение в патологический процесс нейтрофильных гранулоцитов, приток которых обеспечивает выброс протеолитических ферментов (коллагеназы и миелопероксидазы), содержащихся в гранулах нейтрофилов. Повышенное содержание мРНК MIP-1 (р=0,003) и (р=0,002) в миометрии при субмукозной локализации узлов указывает на бльшую вовлеченность моноцитов и Т-лимфоцитов в патологический процесс по сравнению с другими типами расположения узлов. Повышение содержания мРНК СХСR1 (рецептора IL-8) в миометрии (р=0,035) при субмукозной локализации узлов отражает взаимосвязь между экспрессией генов хемокина и рецептора, выраженную в повышении и IL-8 в тканях миомы матки, а СХСR1 в прилегающих интактных клеточных структурах.
Определена связь между темпами роста и экспрессией ССR5 в миометрии. Повышенное содержание мРНК ССR5 при медленном росте миомы матки по сравнению с быстрым ростом (р=0,003) указывает на важное значение обратной связи между синтезом хемокинов и рецепторов в регуляции течения заболевания. CCR5 – рецептор для MIP-1 и и RANTES; очевидно, что при достаточной экспрессии CCR5 в тканях миометрия система взаимодействия хемокин-рецептор действует как сдерживающий фактор роста миомы матки.
Установленная обратная зависимость между содержанием мРНК MIP-1 и продолжительностью заболевания (p=0,004) иллюстрирует уменьшение способности тканей миомы матки к синтезу хемокина по мере развития опухолевого процесса.
Закономерности, обнаруженные при сопоставлении размеров матки и содержания мРНК IL-8 и MIP-1 в миометрии (прямая взаимосвязь между увеличением матки и содержанием мРНК) (p=0,004 и p=0,02 соответственно), возможно, характеризуют компенсаторное увеличение синтеза указанных хемокинов в ответ на прогрессирование миомы матки. Обратная зависимость между синтезом MIP-1 в ткани лейомиомы и размером матки (как и с максимальным размером узла) (p=0,02 и p=0,047 соответственно) отражает вероятную роль этого хемокина в качестве сдерживающего фактора в развитии патологического процесса.
Отмеченное снижение эотаксина-2 в тканях лейомиомы у пациенток с аденомиозом по сравнению с группой без аденомиоза (р=0,026), вероятно, демонстрирует нарушение в процессе эктопии эндометрия функции эозинофилов. Кроме того, отмечено снижение содержания мРНК СХСR2 в тканях лейомиомы (р=0,031) и MIP-1 в миометрии (р<0,040) у пациенток с аденомиозом, что свидетельствует о недостаточности хемокиновой регуляции.
Таким образом, полученные результаты о содержании мРНК хемокинов и рецепторов в интактных и патологически измененных тканях матки при миоме позволяют говорить о вовлеченности в патологический процесс системы хемокинов. Очевидно, что помимо локальных гормональных нарушений, в качестве пусковых механизмов развития миомы матки следует рассматривать дисбаланс местных межклеточных регуляторных структур, частью которых являются хемокины. Возможным объяснением возникновения миомы матки может быть изначально пониженный уровень экспрессии хемокинов и рецепторов в тканях миометрия, что при гормональных сдвигах приводит к неконтролируемой пролиферации миоцитов и коллагена.
Полученные в исследовании данные свидетельствуют о сложных взаимодействиях иммунных и генетических изменений в патогенезе миомы матки, значимость которых может быть сопоставима с общеизвестными воздействиями гормонального дисбаланса на развитие этого заболевания.
Результаты социальнодиагностического и психодиагностического исследования больных миомой матки с различными вариантами клинического течения заболевания
Результаты психодиагностического исследования позволяют подтвердить имеющиеся в литературе данные о роли в генезе опухолевого роста в матке индивидуально-психологических особенностей больных и справедливость отнесения этого заболевания к группе психосоматических (Ильин В.И., 1988; Брехман Г.И., 1990). Особенности психической сферы (как психическое состояние в конкретный момент, так и более стабильные особенности личности) сказываются на изменении гормонального статуса, что оправдывает психосоматический подход к определенным аспектам эндокринной патологии (Карвасарский Б.Д., 1982).
Проведено обследование 114 больных миомой матки. Пациентки были разделены на две группы: в первую включены 21 женщина с бессимптомной миомой матки; во вторую – 93 пациентки, имевшие клиническую симптоматику, связанную с наличием миомы матки.
Pages: | 1 | 2 |
| 4 | 5 | … | 6 |
Источник


