Миома матки дифференцированный подход к лечению
Миома матки — одна из наиболее распространенных доброкачественных опухолей репродуктивной системы у женщин, заболеваемость которой составляет 66–88,2 % от общего числа доброкачественных новообразований у женщин. Чаще миома матки развивается у женщин репродуктивного возраста. В соответствии с различной локализацией, выделяют три основных типа миоматозных узлов: интрамуральные, субмукозные и субсерозные, среди которых преобладает встречаемость интрамуральных узлов. Встречаемость субмукозной миомы составляет 20–40 %, заболевание чаще развивается в возрасте 30–50 лет. Согласно последним исследованиям, заболеваемость миомой матки имеет тенденцию к омоложению.
Результаты наблюдения за пациентками показали, что заболевание оказывает большое влияние на фертильность и менструальную функцию, и, как следствие, приводит к хронической потере крови, прогрессирующей в анемию, привычному невынашиванию беременности, бесплодию и другим симптомам в результате изменения формы и функции матки из-за окклюзии ее полости.
Выделяют два основных направления лечения миомы матки — консервативное и хирургическое.
В арсенале современной фармакологии существует множество средств для лечения миомы матки. Чаще применяется гормональная терапия, использование которой основано на концепции гормонозависимой опухоли. Основным принципом гормонотерапии является создание абсолютной или относительной гипоэстрогении.
Показаниями к гормональной терапии являются размеры миоматозных узлов 2–4 см, отсутствие быстрого роста узлов, нарушения функции соседних органов и противопоказаний к применению препаратов. Также медикаментозная терапия может применяться как подготовительный этап к операции миомэктомия.
Однако эффективность медикаментозной терапии ограничена, так как происходит частое возникновение побочных эффектов, высокая частота рецидивов после отмены препаратов. Немногим пациенткам удается длительно придерживаться лечения. По вышеуказанным причинам хирургическое лечение является наиболее востребованным и применяемым видом лечения миомы матки. Однако решение о применении хирургических методов часто зависит от клинической симптоматики, скорости роста миоматозных узлов и заинтересованности женщины в реализации репродуктивной функции. В целом, основным критерием для определения хирургического метода лечения как основного является размер миоматозных узлов более 3 см с выраженными клиническими симптомами.
Хирургическое лечение подразделяется на традиционное и малоинвазивное.
На сегодняшний день традиционные методы оперативного лечения включают гистерэктомию и миэмэктомию.
Традиционные трансабдоминальные гистерэктомия и миомэктомия были приняты большинством гинекологов в 1950х по причине обширного поля видения для хирурга, что способствовало полному удалению миоматозных узлов. Однако традиционная хирургия сопровождается причинением тяжелой травмы, медленным выздоровлением, серьезными послеоперационными осложнениями и долгосрочным неблагоприятным воздействием на функцию яичников после гистерэктомии. Исследования показали, что у 34 % женщин появились перименопаузальные симптомы и дисфункция яичников через два года после перенесенной гистерэктомии, возраст наступления менопаузы сократился на 4 года по сравнению со среднепопуляционным возрастом наступления менопаузы. Это объясняется перераспределением кровотока в яичниках в результате изменения хода ветвления артерий. Расстройство кровоснабжения яичников влияет на высвобождение эстрогена, и в результате снижения его уровня развивается преждевременная недостаточность яичников.
Рассматривая недостатки и преимущества традиционной миомэктомии с лапаротомическим доступом, следует отметить, что при данном виде операции, наряду с причинением тяжелой травмы, длительной реабилитацией и серьезными послеоперационными осложнениями, обеспечивается тактильный контакт, что позволяет полноценно выполнить необходимый объем миомэктомии при наличии множественных, в том числе глубоко расположенных, интерстициальных узлов. Кроме того, при множественных узлах интерстициальной и интерстициально-субмукозной локализации их вылущивание осуществляется гораздо легче и быстрее, с правильным анатомическим сопоставлением краев ложа миоматозного узла и последующим ушиванием в несколько рядов.
С 1980х в связи с развитием лапароскопической техники, гистероскопии и других эндоскопических методик, в связи с особым акцентом на индивидуальный и гуманный подход в хирургии и стремлением к эффективному лечению, одновременно уменьшая повреждение тела, началась активная разработка и изучение альтернативных методов хирургического лечения миомы матки.
В настоящее время выделяют следующие виды гистерэктомии: абдоминальная, вагинальная, лапароскопическая и робот-ассистированная лапароскопия. К преимуществам малоинвазивных методик относят менее интенсивный болевой синдром, снижение времени пребывания в стационаре, снижение риска инфекционных осложнений и кровопотери, лучший косметический эффект. Однако вследствие необходимости использования дорогостоящей медицинской аппаратуры и потребности в высококвалифицированных подготовленных по данному направлению кадров, использование лапароскопических методик ограничено и нет возможности повсеместного их применения.
Согласно последним исследованиям, гистерэктомия с помощью влагалищного доступа в лечения миомы матки по-прежнему имеет больше преимуществ по сравнению с гистерэктомией с лапароскопическим доступом. К таковым относят меньшая длительность операции и время пребывания в стационаре, более низкая стоимость при такой же частоте послеоперационных осложнений. С другой стороны, лапароскопическая гистерэктомия имеет некоторые преимущества по сравнению с влагалищной гистерэктомией, а именно возможность ревизии брюшной полости. Отсутствие родов, наличие оперативных вмешательств в анамнезе, эндометриоз зачастую являются основанием для выбора лапароскопического доступа. Тогда как наличие родов в анамнезе, малые размеры матки и пролапс часто ассоциированы с влагалищным доступом. Кроме того, опыт и навыки хирурга в значительной степени определяют выбор метода гистерэктомии.
Миомэктомия является операцией выбора для женщин репродуктивного возраста с нереализованной генеративной функцией и желанием сохранить менструальную функцию. К основным преимуществам миомэктомии по сравнению с гистерэктомиией следует отнести вышеописанное отсутствие развития дисфункции яичников и сокращения менопаузального возраста. Также отмечено значительное снижение либидо у пациенток, перенесших гистерэктомию.
К основным видам миомэктомии относят лапароскопическую, трансцервикальную и вышеописанную лапаротомическую.
Исследования показали, что методы лапароскопической и трансцервикальной миомэктомии характеризуются меньшей кровопотерей, более щадящим воздействием на тело пациентки, скорейшей постоперационной реабилитацией и меньшим влиянием на репродуктивную эндокринную систему по сравнению с классической методикой.
Сравнивая лапароскопическую и трансцервикальную миомэктомию, следует отметить, что трансцервикальная миомэктомия характеризуется более коротким периодом восстановления после операции, меньшим временем пребывания в стационаре и скорейшей нормализацией нарушений сна.
Эмболизация маточных артерий (ЭМА) — современное органосохраняющее оперативное вмешательство, представляющее собой лечение миомы матки путем блокирования кровотока по артериям, кровоснабжающим фиброматозные узлы. При этом они уменьшаются в размерах, сохраняется способность к дальнейшему выполнению репродуктивной функции. Это минимально агрессивное, незначительно болезненное вмешательство, выполняемое под местной анестезией. Согласно литературным данным 78–94 % женщин после ЭМА избавляются от беспокоящих симптомов и испытывают улучшение качества жизни.
ЭМА показана при субсерозных на широком основании, интерстициальных и субмукозных миоматозных узлах. Диаметр доминантного узла допускается не более 7 см при размерах матки до 12 недель беременности. Также показанием к ЭМА является рецидив миомы матки после миомэктомии, бесплодие в сочетании с миомой матки, высокая степень анестезиологического риска, обусловленного экстрагенитальной патологией.
После выполнения ЭМА время реабилитации меньше по сравнению с гистерэктомией и миомэктомией и составляет 1–2 недели, время пребывания в стационаре составляет 3–7 дней, наблюдается меньшее количество осложнений.
ЭМА может выполняться как подготовительный этап перед миомэктомией. Миомэктомия может приводить к значительной потере крови в случаях наличия больших или множественных миоматозных узлов в результате их гиперваскуляризации, что требует многократной гемотрансфузии или гистерэктомии. Следовательно, в случаях повышенного риска массивного кровотечения оправдано проведение предшествующей эмболизации маточных артерий.
К одним из новых неинвазивных методов хирургического лечения можно отнести фокусированную ультразвуковую аблацию миомы. Данный метод основан на нагревании тканей узлов высокоинтенсивным фокусированным ультразвуком, что приводит к некрозу узлов. В настоящее время данным методом проводится лечение миоматозных узлов диаметром до 9 см. Процедура производится амбулаторно без наркоза и специальной предварительной подготовки. ФУХ-метод был разработан израильской компанией «Инсайтек» и в настоящее время используется лишь в семи странах мира: в Израиле, Великобритании, Венгрии, Германии, США, Канаде и Японии
Таким образом, приведенные данные указывают на необходимость индивидуального подхода к выбору тактики лечения миомы матки с учетом размеров и расположения узлов, скорости роста узлов, клинической симптоматики, возраста и репродуктивного потенциала женщины, анамнеза заболевания, наличия экстрагенитальной патологии, наличия необходимого технического оборудования и навыков медицинского персонала.
Литература:
1. Yuxue Zhang, Xiaoli Gu, Yuejin Meng, Haizhou Guo, Jiehua Du, Wei Xing. Analysis of the effect of laparoscopy and hysteroscopy on ovarian function, immune function and quality of sexual life of patients with hysteromyoma at different ages // Oncology Letters. — 2018. — № 15(3). — С.2929–2934.
2. Schnapauff D, Russ M, Kröncke T, Davi M. Analysis of presurgical uterine artery embolization (PUAE) for very large uterus myomatosus; patient’s desire to preserve the uterus; case series and literature review // Fortschr Röntgenstr. — 2018. — № 7. — С.121–128.
3. Andres MP, Borrelli GM, Abrao MS. Advances on minimally invasive approach for benign total hysterectomy: a systematic review // F1000Research. — 2017. — № 6. — С.1295–1302.
4. Т. А. Смирнова, В. В. Лобунова. Современные взгляды на лечение миомы матки // Медицинский журнал. — 2008. — № 2. — С.45–55.
5. Ю. К. Малевич. Справочник врача женской консультации / Беларусь, 2014. — 415 с.
6. Ищенко Л. И., Ботвин М. А., Ланчинский В. И. Миома матки: этиология, патогенез, диагностика, лечение. Видар-М: Медицинская литература, 2010. 244 с.
Основные термины (генерируются автоматически): узел, хирургическое лечение, миома матки, лечение миомы матки, медикаментозная терапия, менструальная функция, подготовительный этап, репродуктивная функция, клиническая симптоматика, гормональная терапия.
Источник
Статье посвящена безоперационному лечению миомы матки. Представлены результаты исследования по оценке эффективности препарата Гинестрил при лечении симптомной миомы матки. Показано, что клиническая эффективность и хорошая переносимость препарата Гинестрил позволяют успешно использовать его при лечении миомы матки у женщин репродуктивного возраста.
Миома матки – одна из наиболее распространенных доброкачественных опухолей женской половой сферы, которая возникает у 20–40% женщин репродуктивного возраста [1–3]. У пациенток детородного возраста в структуре гинекологической заболеваемости миома матки занимает одно из ведущих мест. Несмотря на совершенствование методов профилактики, диагностики и лечения, частота встречаемости данной патологии не только не снижается, но и отмечается тенденция к ее неуклонному росту (E. Tamawa et al., 2011). Данная доброкачественная гормонально зависимая опухоль требует преимущественно радикального лечения, в связи с чем по поводу миомы матки выполняется до 50–70% оперативных вмешательств в гинекологических стационарах [1, 4, 5].
Однако, по данным зарубежной и отечественной литературы, у 50% пациенток в ближайшие и отдаленные сроки после оперативного вмешательства существенно ухудшается качество жизни, появляются психоэмоциональные, нейроэндокринные и соматические нарушения. Резко возрастает дефицит половых стероидов (прежде всего, эстрогенов), что способствует системным изменениям в органах и тканях, дефицит андрогенов усугубляет клиническую картину. Такие же изменения возникают в 30% случаев у пациенток после гистерэктомии с сохранением придатков с одной или с обеих сторон [6–8]. Развитие подобной симптоматики связано со снижением функции яичников из-за нарушения анатомии, иннервации и кровоснабжения [6, 8].
В вопросе реабилитации пациенток после гинекологических операций наиболее значимой является проблема отдаленных результатов гистерэктомии [8]. Если больной миомой матки не показано оперативное лечение, то необходимо рассмотреть вопрос об альтернативных методах. На сегодняшний день активно обсуждается вопрос профилактики развития и консервативного лечения миомы матки, что в некоторой степени может уменьшить число хирургических вмешательств.
Учитывая, что определенную роль в развитии миомы матки играют эстрогены и различные изоформы прогестерона в сочетании с повышенным содержанием митогенных факторов роста, гормональной терапии отведено ведущее место в консервативном лечении данного заболевания [1, 9–11].
В литературе есть мнение, что при бессимптомном течении миом, за исключением миом больших размеров (более 5 см), нет оснований для назначения лекарственных средств [1, 4]. По данным других авторов, выжидательная тактика при бессимптомном течении миомы матки и небольших размерах недопустима, т.к. в последующем это может привести к оперативному лечению [12, 13].
Согласно рекомендациям Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), агонисты гонадотропин-рилизинг-гормона признаны единственным лекарственным средством, способным не только уменьшить симптоматику, обусловленную миомой матки, но и временно воздействовать на объем миоматозных узлов. Однако продолжительность лечения ограничена сроком 6 мес. в связи с риском побочных эффектов. После отмены препарата через 2–3 мес. объемы миоматозных узлов приближаются к исходным параметрам [1, 14].
В настоящее время для лечения миомы матки используется улипристала ацетат, который влияет на размер миоматозного узла, не оказывая при этом побочных гипоэстрогенных эффектов [1, 15].
Мы представляем опыт медикаментозного лечения миомы матки синтетическим стероидным препаратом, конкурентным ингибитором прогестерона – мифепристоном (Гинестрил®). Клинический эффект его обусловлен блокированием действия прогестерона на уровне рецепторов. Препарат является также антагонистом андрогенов и глюкокортикоидов. В настоящее время используется в качестве монотерапии у больных миомой матки. Одной из важнейших особенностей действия Гинестрила является отсутствие гипоэстрогении, поэтому не наблюдается ни вазомоторных симптомов, ни снижения минеральной плотности костной ткани. Рекомендуемая доза для лечения миомы матки – 50 мг/сут.
Цель исследования: oценить эффективность препарата Гинестрил® в дозе 50 мг/сут при лечении симптомной миомы матки размером до 12 нед. условной беременности.
Материал и методы
B ходе оценки эффективности препарата на базе гинекологического отделения Городской клинической больницы № 1 им. Н.И. Пирогова (Москва) было проведено комплексное клинико-лабораторное обследование и лечение 60 больных миомой матки.
Критерий отбора в исследование – наличие симптомной миомы матки до 12 нед. условной беременности.
Из исследования исключались больные: в возрасте более 45 лет; с миомой матки с узлами 0-го типа субсерозной и субмукозной локализации; полипами эндометрия, атипической гиперплазией и раком тела матки; опухолями яичников и молочных желез; подозрением на саркому матки; острыми воспалительными заболеваниями органов малого таза; тяжелой соматической патологией; размерами матки более 12 нед. условной беременности; аллергическими реакциями на мифепристон; беременностью; в периоде лактации.
В процессе комплексного обследования, кроме клинико-анамнестических методов, использовались инструментальные и лабораторные методы.
Эхографическое исследование органов малого таза. Ультразвуковое исследование (УЗИ) выполнялось с ультразвуковым триплексным ангиосканированием сосудов малого таза с определением скорости кровотока по маточным, яичниковым артериям и их ветвям. Исследование выполнялось на аппарате Ultramarc-8 фирмы ATL (США), снабженном секторальным механическим датчиком с частотой 5,0, 7,5 и 10 МГц, и аппарате Acuson 128/XP-10 фирмы Acuson (США) с мультичастотным секторным датчиком 2,5–4 МГц, мультичастотным конвексным датчиком 2,5–3,5 МГц и линейным датчиком 5,0 и 7,0 МГц. УЗИ выполнено сотрудниками отделения ультразвуковой диагностики ГКБ № 1 им. Н.И. Пирогова.
Исследование гормонального профиля, включающее определение лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), эстрадиола в сыворотке крови, проводилось при помощи хемилюминесцентного метода на микрочастицах, на аппаратах Architect 2000 SR фирмы Abbott (Германия) до начала лечения, через 3 и 6 мес. после начала лечения в клинической диагностической лаборатории «Медсервис/ Диагностика».
Гистероскопия выполнялась с помощью эндоскопического оборудования фирмы Karl Storz (Германия) по стандартной методике. Для анестезиологического пособия при гистероскопии применяли внутривенный наркоз. Под контролем гистероскопии выполняли раздельное диагностическое выскабливание слизистой цервикального канала и стенок полости матки.
Препарат Гинестрил® назначался с целью уменьшения размеров матки и миоматозных узлов 30 пациенткам в возрасте от 25 до 45 лет в дозе 50 мг ежедневно перорально в течение 6 мес., лечение начиналось со второго дня менструального цикла. Средний возраст пациенток 1-й группы составил 35,0±4,27 года.
Для сравнения была выделена группа пациенток, которым с целью уменьшения размеров миомы матки назначался бусерелин инъекционно по стандартной схеме в течение 6 мес. Средний возраст пациенток 2-й группы составил 38,2±3,4 года.
Эффективность проведенной терапии оценивалась через 3 и 6 мес. в ходе лечения, через 3 и 6 мес. после окончания лечения.
При сборе анамнеза в 1-й группе 29 (96,7%) пациенток предъявляли жалобы на обильные менструации, у 12 из них менструации были болезненными и у 23 длительными (от 8 до 10 дней). При сборе анамнеза во 2-й группе 26 (86,7%) пациенток предъявляли жалобы на обильные менструации, у 8 из них менструации были болезненными и у 19 длительными (от 8 до 10 дней).
При проведении сравнительного анализа наследственности, детородной функции, гинекологического статуса, сопутствующей патологии обе группы были сопоставимы, значимых отличий не выявлено.
При УЗИ у большинства (58,6%) пациенток с миомой матки были выявлены единичные миоматозные узлы. В зависимости от локализации и характера роста 15% из них были отнесены к субсерозным узлам I типа, 27,1% – к субсерозным II типа, 18,7% – к интерстициальным и 41,1% – к субмукозным узлам II типа. Более чем у половины (53,4%) больных при изучении структуры и кровоснабжения узлов были выявлены интерстициальные и интерстициально-субсерозные миомы неоднородной эхоструктуры, повышенной эхогенности с преобладанием периферической васкуляризации над центральной. В 31,9% случаев было установлено наличие гипоэхогенных узлов с неоднородной эхоструктурой и смешанной васкуляризацией, в большинстве случаев – субмукозных II типа. Еще один тип узлов – изоэхогенные с однородной эхоструктурой и смешанным типом васкуляризации – относились преимущественно к интерстициальной локализации.
Учитывая наличие нарушений менструальной функции, до начала проведения терапии 19 (63,3%) пациенткам проводилось раздельное диагностическое выскабливание под контролем гистероскопии. По данным морфологического исследования нарушений выявлено не было, и исследование было продолжено.
Результаты исследования
По итогам лабораторных исследований до начала лечения было установлено достоверное снижение основных показателей общеклинического анализа крови по сравнению с нормативными показателями, динамика уровня гемоглобина отображена на рисунке 1. По данным клинического анализа крови установлено достоверное снижение частоты анемии.
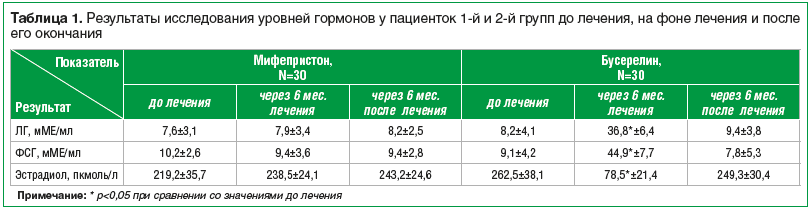
Данные литературы указывают на важную роль нарушений гормонального гомеостаза в патогенезе пролиферативных заболеваний [16, 17]. Однако в нашем исследовании у пациенток до лечения средние показатели ЛГ, ФСГ, эстрадиола находились в пределах референсных значений, установленных для репродуктивного возраста, и не имели достоверных различий. На фоне лечения мифепристоном и спустя 6 мес. после лечения значимых отличий не было. При применении бусерелина отмечалось закономерное достоверное повышение уровней ФСГ и ЛГ и достоверное снижение уровня эстрадиола до уровней, характерных для постменопаузального периода, с чем и были связаны побочные эффекты у пациенток 2-й группы. Однако через 6 мес. после лечения все показатели значимо не отличались от показателей, имевшихся до лечения (табл. 1).
При изучении динамики изменений размеров матки в процессе лечения и после него отмечено уменьшение объема матки у пациенток 1-й группы на 30%, у пациенток 2-й группы на 35%, т. е. на фоне лечения бусерелином отмечается более выраженное уменьшение объема матки. Однако через 6 мес. после лечения объем матки увеличился, причем при использовании бусерелина более значимо (рис. 2).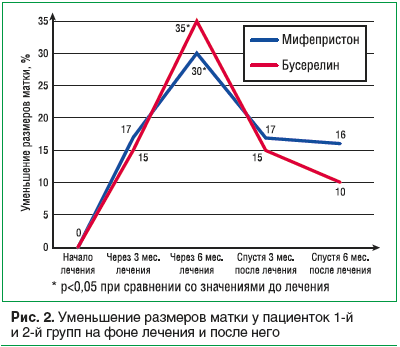
У пациенток 1-й группы в процессе лечения и после него отмечено уменьшение объема матки в 1,2 раза через 3 мес. терапии, в 1,4 раза через 6 мес. Через 6 мес. после окончания лечения отмечалось незначительное увеличение объема матки, но при сравнении с исходными данными размеры матки были в 1,2 раза меньше. У пациенток 2-й группы в процессе лечения и после него отмечено уменьшение объема матки в 1,18 раза через 3 мес. терапии, в 1,5 раза через 6 мес. Через 6 мес. после окончания лечения отмечалось увеличение объема матки, но при сравнении с исходными данными размеры матки были в 1,1 раза меньше.
То есть при применении Гинестрила отмечается чуть менее выраженное уменьшение объема матки, чем при применении бусерелина (без статистически достоверной разницы между группами пациенток), но эффект после лечения сохраняется дольше (рис. 2).
В процессе лечения препаратом Гинестрил® отмечалось значительное увеличение толщины эндометрия на фоне аменореи в отличие от 2-й группы, где на фоне лечения отмечалось значительное уменьшение М-эхо. Так, через 3 мес. терапии у пациенток 1-й группы М-эхо увеличилось в 1,4 раза, через 6 мес. – в 1,9 раза, через 3 мес. после окончания терапии средняя величина М-эхо была меньше в 1,16 раза по сравнению с исходными значениями (табл. 2).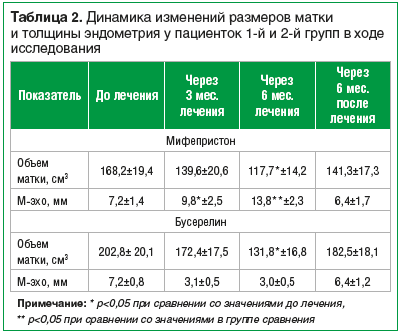
На фоне применения препарата Гинестрил®, помимо увеличения толщины эндометрия, отмечалось изменение его структуры: неоднородность, множественные анэхогенные включения.
Учитывая данные УЗИ органов малого таза, в связи с подозрением на гиперплазию эндометрия в ходе исследования 11 (36,7%) пациенткам 1-й группы проводилось раздельное диагностическое выскабливание под контролем гистероскопии. По данным гистологического исследования отмечался пролиферативный эндометрий с кистозным расширением желез, что не является морфологической картиной железистой гиперплазии эндометрия.
Учитывая результаты гистологического исследования (отсутствие гиперплазии эндометрия), от проведения раздельного диагностического выскабливания под контролем гистероскопии в дальнейшем отказались.
Сразу после отмены препарата пациентки 1-й группы отмечали обильную и продолжительную первую после проведенного курса лечения менструацию. При УЗИ органов малого таза после прекращения кровяных выделений патологии не выявлено, толщина эндометрия соответствовала ранней пролиферативной фазе. В дальнейшем нарушений менструальной функции не отмечалось.
Выводы
Сравнительный анализ эффективности применения препаратов мифепристона и бусерелина показал преимущество препарата Гинестрил® (мифепристон) при лечении симптомной миомы матки у женщин. Изучение динамики изменений размеров матки в процессе лечения мифепристоном и бусерелином и после лечения показало достоверно значимое уменьшение размера матки по обоим препаратам, однако эффект после лечения Гинестрилом сохранялся дольше.
Клиническая эффективность и хорошая переносимость препарата Гинестрил® позволяют успешно использовать его при лечении миомы матки у женщин репродуктивного возраста.
Источник