Миома матки и невынашивание
Миома матки и беременность.
 Диагноз «лейомиома (миома) матки» женщина может услышать от врача на плановом осмотре при подготовке к беременности.
Диагноз «лейомиома (миома) матки» женщина может услышать от врача на плановом осмотре при подготовке к беременности.
Мы уже говорили о том, что бессимптомная миома не требует никакого лечения. Женщину, которая готовится к беременности, часто запугивают, что фиброматозные узлы могут препятствовать зачатию и вынашиванию ребенка.
Страхи эти сильно преувеличены.
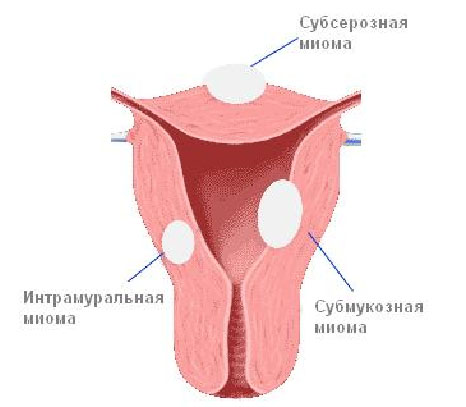
Большинство фиброматозных узелков расположены субсерозно, не в полости матки. Они не изменяют полость матки и, соответственно, не мешают забеременеть, выносить и родить малыша. Даже если узел больших размеров, но находится не в полости матки, он не мешает зачатию и вынашиванию.
Небольшие субмукозные узлы в большинстве своем тоже не влияют на зачатие и беременность. Они мешают, если располагаются рядом с просветом маточных труб, и перекрывают его, а также рядом с внутренним зевом шейки матки. То есть, нарушают процесс оплодотворения и имплантации.
Если у Вас нашли фибромиому матки, и вы планируете рожать, то нужно очень внимательно и избирательно отнестись к предлагаемому лечению.
Очень редко оперативное удаление миомы матки повышает шанс оплодотворения и вынашивания ребенка.
Рекомендации по лечению должны быть индивидуальными: с учетом жалоб женщины, расположения узла, его размера и скорости роста. Так же важно учитывать возраст женщины и её планы по поводу рождения детей.
В большинстве случаев миома матки не препятствует детородной функции и не требует традиционного медикаментозного или оперативного лечения.
Миома матки и невынашивание беременности
Большое количество женщин прекрасно вынашивают и рожают детей, имея миому матки.
К невынашиванию беременности и преждевременным родам может привести расположение узлов в области внутреннего зева шейки матки и рядом с перешейком, если эти узлы при этом большие (больше 5 см).
Так же требуется обратить внимание, если плацента расположена в стенке матки, в которой есть фиброматозные узлы. У такой женщины, возможно, будет плохо сокращаться стенка матки, и она находится в группе риска отслойки плаценты и развития кровотечения.
Большие или множественные фиброматозные узлы могут нарушать естественный родовой процесс. Тогда родоразрешение будет осуществляться через кесарево сечение.
Если узел — миома субмукозная — растет в полость матки и деформирует её, то возможно самопроизвольное прерывание беременности.
Влияние беременности на миоматозные узлы:
- Примерно у половины женщин миоматозные узлы практически не увеличиваются.
- Уменьшаются во время беременности у 8-27% женщин;
- Увеличиваются у 22-32% женщин. От исходного размера увеличение в среднем на 12%. В редких случаях могут увеличиться на 25% и более.
- Увеличение узлов происходит, в основном, в первый триместр беременности.
- Маленькие узлы (до 5 см), чаще всего, не изменяются в размерах.
Рост узлов происходит в ответ на увеличение продукции прогестерона яичниками во время беременности. После родов количество гормона снижается, и размеры миоматозного узла уменьшаются.
Обычно увеличение миомы во время беременности не опасно ни для женщины, ни для ребенка. Возможны изменения внутри узла — кровоизлияния, омертвление ткани. На беременность это не влияет и, следовательно, удаление узлов не требуется. Оперативное удаление узлов во время беременности опасно развитием кровотечения.
Влияние на развитие ребенка
Если узлы небольших размеров, то никакой опасности для развития ребенка нет.
Если узлы деформируют полость матки, то они могут привести к неправильному расположению плода — поперечному. Родоразрешение в этом случае будет путем кесарева сечения.
Редко может наблюдаться задержка развития плода. Поэтому очень важно наблюдать свою беременность у хорошего врача или акушерки.
Читайте так же:
Заблуждения о фибромиоме матки.
Миома матки. Причины развития.
Миома матки. Лечение.
Смотрите лекцию из цикла «Женское здоровье «- «Миома матки. Бережное лечение»
Подробности ЗДЕСЬ https://plodnost.ru/wppage/endometrioz-mioma-giperplaziya
Источник
Проблема лечения больных миомой матки и эндометриозом продолжает оставаться актуальной в современной гинекологии ввиду высокой частоты этой патологии, а также ее отрицательного влияния на репродуктивную систему и общее состояние здоровья женщины. Встречаясь изолированно или сочетанно, эти заболевания часто приводят к бесплодию и невынашиванию беременности [2,5].
Несмотря на многочисленные теории патогенеза миомы и эндометриоза, общепризнано мнение об их возникновении на фоне гиперэстрогении, прогестерондифицитных и гипергонадотропных состояний. Многие авторы считают, что эти заболевания и нарушения репродуктивной функции женщин обусловлены одними и теми же нарушениями в гипоталамо–гипофизарно–яичниковой системе [1,3]. Однако наличие миомы и эндометриоза, в свою очередь, усугубляет изменения гормонального гомеостаза и морфофункциональную неполноценность эндометрия, тем самым замыкая «порочный круг» нарушения репродуктивной функции. В связи с этим особую значимость приобретает тактика ведения пациенток с бесплодием и невынашиванием беременности на фоне миомы матки и эндометриоза.
Патогенетически обоснованной концепцией лечения этих заболеваний является комбинированное воздействие – хирургическое и медикаментозное [3]. В литературе широко дискутируется вопрос о последовательности этих методов, необходимости удаления небольших (до 3 см) миоматозных узлов, длительности гормональной терапии и выбора препарата.
Медикаментозная терапия может применяться в качестве самостоятельного метода, а также в до– и послеоперационном периоде. Основная цель ее – уменьшение тяжести клинических симптомов, а в ряде случаев – восстановление фертильности. Она предполагает применение препаратов, так или иначе подавляющих продукцию эстрогенов: прогестагенов, производных этистерола и агонистов рилизинг–гормона лютеинизирующего гормона (ЛГРГ). Длительное применение прогестагенов (медроксипрогестерона ацетат, неместран) приводит к формированию гипоэстрогенизма, что, в свою очередь, вызывает атрофию эндометрия. Механизм действия даназола отличается большой сложностью и включает ингибирование стероидогенеза в яичниках и надпочечниках, взаимодействие с рецепторами андрогенов, прогестерона и глюкокорткоидов, а также с глобулином, связывающим кортикостероиды [3,4]. Все эти эффекты индуцируют гипоэстрогенное и гиперандрогенное состояние, которое ухудшает условия роста эндометриоидных имплантантов и миоматозных узлов. Однако терапия даназолом сопровождается многочисленными системными и обменными расстройствами, а также побочными эффектами гипоэстрогенизма и гиперандрогенизма. Это стимулировало поиск новых альтернативных способов гормональной терапии эндометриоза. С 80–х годов ХХ века начато применение аналогов ЛГРГ (Золадекс и др.). Их воздействие на гипофиз приводит к гипогонадотропизму в сочетании со значительным подавлением продукции эстрогенов и прогестерона в яичниках, соответствующих состоянию фармакологической менопаузы [4,5].
В настоящей работе проведен анализ применения Золадекса в прегравидарной подготовке 38 женщин в возрасте от 24 до 38 лет, страдающих невынашиванием беременности на фоне миомы матки и эндометриоза. У 32 из них миома матки сочеталась с аденомиозом, у 6 – с наружно–внутренним эндометриозом. Длительность заболевания колебалась от 1 года до 8 лет (в среднем около 4 лет). Анализ анамнестических данных показал, что из перенесенных заболеваний у обследуемых пациенток наиболее часто встречались: хронический тонзиллит (39,4%), вегето–сосудистая дистония (18,6%), заболевания желудочно–кишечного тракта (24,3%), хронические заболевания верхних дыхательных путей (8,2%). В исследование не включались женщины с гипертонической болезнью, ожирением, варикозным расширением вен различной локализации.
Воспалительные заболевания матки и придатков отмечались у 13 (34,2%) пациенток (хронический сальпингоофорит – 9, хронический эндометрит – 4). Более чем у половины женщин 26 (68,4%) имелась дисфункция яичников, 17 пациенток страдали привычным невынашиванием беременности, 5 – вторичным бесплодием, у 16 женщин были спорадические выкидыши.
Всем больным проводилось общеклиническое, лабораторное (общий и биохимический анализы крови, коагулограмма) обследование, ультразвуковое исследование (УЗИ) с цветным допплеровским картированием, выполненное на аппарате «Аuson 128 XP/10» с помощью вагинального датчика частотой 7 МГц, определение содержания гонадотропных и яичниковых гормонов в плазме периферической крови иммуноферментным методом (до, в процессе лечения и после его окончания), морфологическое исследование биоптатов и материала соскоба эндометрия.
Клинические проявления заболевания выявлены у 32 (84,2%) пациенток: болевой синдром – у 17, меноррагии – у 9, ациклические кровянистые выделения – у 6 женщин. В 7 случаях отмечена вторичная анемия (Нb 8,4±1,3 г/л). Определение уровня гормонов в крови обследуемых женщин показало увеличение средних значений ЛГ (12,8±2,3 МЕ/л), нормальные или сниженные значения ФСГ (4,1±1,3 МЕ/л), абсолютную или относительную прогестероновую недостаточность (уменьшение содержания прогестерона до 11,2±3,4 нмоль/мл при уровне эстрадиола 510±22 нмоль/мл). Тесты функциональной диагностики свидетельствовали о недостаточности лютеиновой фазы менструального цикла в 98% случаев. При ультразвуковом исследовании, проводимом на 5–7 день цикла, оценивались величина, расположение миоматозных узлов, общий объем матки, состояние эндо–, миометрия, размеры и структурные особенности яичников; с помощью цветного допплеровского картирования изучалась гемодинамика в a. ovaricae и a. uterinae. Критерием качественной оценки состояния кровотока служил показатель систоло–диастолического соотношения (С/Д).
Размеры матки в начале лечения в среднем соответствовали величине 6–8 недельной беременности. Отмечалось преимущественно межмышечное расположение узлов (22 случая), реже – субсерозное (12) и субмукозное (4).
Оперативная лапароскопия предшествовала гормональной терапии в 6 случаях: диатермокоагуляция очагов эндометриоза – 4, консервативная миомэктомия – 2. Гистероскопия произведена 9 пациенткам по поводу железисто–кистозной гиперплазии эндометрия (6) и полипов эндометрия (3).
Морфологическое исследование биоптатов эндометрия, взятых на 22–24 дни менструального цикла с помощью аспирационной кюретки – пайпель выявило отставание секреторных преобразований эндометрия разной степени в 31 (81,6%) случае. Причем у 18 пациенток состояние эндометрия соответствовало ановуляторному циклу, о чем свидетельствовало наличие в микропрепаратах признаков пролиферативной фазы цикла, характеризующейся линейным ходом маточного эпителия с единичными устьями маточных желез, отсутствие их разветвлений и скудность секрета в них. В 13 случаях структура эндометрия свидетельствовала о недостаточности лютеиновой фазы с отставанием секреторных преобразований на 4–6 дней, на что указывали прямой ход желез, выходящих в просвет матки, отсутствие четкой щеточной каймы, преобладание в строме типичных фибробластов, малых лимфоцитов и новообразованных капилляров. У 7 пациенток выявлена гиперплазия эндометрия, при которой наблюдалось резко увеличенное количество разнообразных по форме и величине маточных желез, активная пролиферация желез и стромы эндометрия, а плотная, местами густая, отечная строма эндометрия была представлена овальными клетками также в состоянии активной пролиферации. Этим пациенткам была произведена гистероскопия с выскабливанием стенок полости матки.
Все пациентки получали Золадекс в инъекционной форме по 3,6 мг 1 раз в 28 дней курсом 3 месяца (21 женщина) и 6 месяцев (17 женщин). Уже после первой инъекции препарата стойкая аменорея наступила у 37 (97,4%) больных, лишь в 1 случае наблюдались скудные кровянистые выделения из половых путей в течение первых двух недель. Через 1–2 месяца исчезали болевые ощущения, отмечалось восстановление гемоглобина у больных с исходной анемией (от 8,9 до 11,4 г/л). Результаты гормонального исследования через 2 недели после инъекции свидетельствовали о резком снижении уровней ЛГ, ФСГ (до 3,6±0,7 МЕ/л и 2,6±0,4 МЕ/л соответственно) и эстрадиола (до 134±12 нмоль/мл).
На фоне применения Золадекса наблюдалось резкое изменение кровоснабжения матки по данным допплерометрического картирования, свидетельствующим о наличии выраженного сосудистого спазма маточной и яичниковых артерий, достигающего максимальных значений к концу 3 месяца и сохраняющегося почти на том же уровне до 6 месяца приема препарата (табл. 1), что, очевидно, объясняется гипоэстрогенией. В то же время подобное нарушение кровоснабжения матки способствует уменьшению ее объема.
Нормативные значения систоло–диастолического соотношения в а. utеrinae 2,20–2,66, a. оvaricae 2,89–3,35.
Средний объем матки через 3 месяца уменьшался на 55–60%, а через 6 месяцев – от 65 до 70%, при этом ее размеры соответствовала нормальной или увеличенной до 5–6 недель беременности (табл. 2).
Из таблицы 2 видно, что наиболее интенсивное уменьшение размеров матки под влиянием Золадекса происходило в течение первых трех месяцев. Необходимость в консервативной миомэктомии возникла лишь у 3 (7,9%) пациенток с субсерозно расположенными миоматозными узлами, которые наименее чувствительны к гормональной терапии.
Подавление функции яичников и наступление псевдоменопаузы сопровождалось рядом побочных симптомов, характерных для климактерического синдрома: приливы жара, потливость, головные боли, сухость во влагалище. Они были наиболее выражены при 6–месячном курсе лечения, но не потребовали отмены препарата.
Для уменьшения интенсивности проявлений эстрогенной недостаточности назначались витаминные, седативные, гомеопатические препараты. Достаточно выраженный терапевтический эффект и минимальное побочное действие, наблюдаемые при назначении Золадекса в течение 3 месяцев, позволили нам в ряде случаев ограничить курс лечения этим сроком.
Все указанные симптомы имели временный характер и проходили после отмены препарата.
Исходные уровни гонадотропных, стероидных гормонов, гемодинамика сосудов матки и придатков восстанавливались через 1,5–2 месяца после отмены Золадекса. Однако по данным тестов функциональной диагностики, результатам гормонального и гистологического исследований у 21 (55,3%) пациенток отмечалась недостаточность лютеиновой фазы цикла. В этих случаях на этапе планирования беременности проводилась терапия гестагенами во вторую фазу цикла в течение 3 месяцев и в 9 случаях – индукция овуляции клостилбегитом. Следует отметить, что чем меньше был возраст больных, тем быстрее у них восстанавливалась функция яичников и состояние эндометрия, что согласуется с мнением Абашовой Е.И. (1999) и других авторов.
Анализ течения беременности, наступившей у 34 пациенток (в 4 случаях выявлены дополнительные факторы бесплодия), показал, что ни в одном случае не наблюдалось сколько–нибудь значительного увеличения миоматозных узлов. Учитывая исходные особенности гормонального фона, всем беременным проводилась профилактика невынашивания беременности гестагенами, спазмолитическими и токолитическими препаратами, а также фетоплацентарной недостаточности (комплексы метаболитов, адаптогенов, витамины, актовегин).
Особенно отрадно отметить факт отсутствия репродуктивных потерь у наблюдаемых пациенток, что является безусловным показателем эффективности применения Золадекса для лечения миомы матки и эндометриоза у женщин с невынашиванием в анамнезе.
Таким образом, применение Золадекса в прегравидарной подготовке женщин с невынашиванием на фоне миомы матки и эндометриоза, последующая коррекция гормональной функции яичников и структурных преобразований эндометрия а также рациональное ведение следующей беременности обеспечивают восстановление репродуктивной функции и рождение желанных детей.
Литература
1. Абашова Е.И. Наружный генитальный эндометриоз и гормональная недостаточность яичников: Автореф. Дис….канд. Мед. наук. –СПб., 1999. – 23 с.
2. Баскаков В.П. Состояние репродуктивной функции женщин при эндометриозе // Пробл. Репрод. – 1995. – №2. – с. 15–18.
3. Баскаков В.П. Медикаментозное лечение эндометриоза //Вестник Российской ассоциации акуш.–гинеколоов. – 2000. – №3. –С.121.
4. Краснопольский В.И. Ищенко А.И., Кузьмина З.В., Герштейн Е.С. Изменение рецепторов стероидных гормонов при распространенных формах эндометриоза, гиперпластических и злокачественных процессах //Акуш. и гинекол. – 1995. – №5. – с. 3–6.
5. Савицкий Г.А., Горбушин С.М. Перитонеальный эндометриоз и бесплодие (клинико–морфологические исследования). – СПб, «ЭЛБИ–СПб». – 2002. –170 с.
Источник
Автор: Шумейкина Ю.В., акушер-гинеколог, репродуктолог Новосибирского центра репродуктивной медицины.
Миома матки (лейомиома) — одна из самых распространённых опухолей женской половой сферы. Это заболевание диагностируют у 20-27% женщин фертильного возраста.
Миома матки (лейомиома) — одна из самых распространённых опухолей женской половой сферы. Это заболевание диагностируют у 20-27% женщин фертильного возраста. В последние десятилетия миому матки ко времени реализации детородной функции отмечают всё в большем количестве случаев, так как в связи с социальными мотивами женщины откладывают рождение детей на более поздний период репродуктивного возраста. В связи с этим совершенно логично, что у них все чаще появляются вопросы относительно возможности забеременеть при наличии миомы матки или после ее удаления, о ее влиянии на течение беременности и роды.
Что же такое миома?
Миома — это доброкачественная опухоль из мышечной ткани, которая постепенно может стать фибромиомой, если к процессу новообразования кроме тканей мышечных, присоединяются соединительные ткани, стремительно разрастающиеся и преобразующие структуру опухоли.
Каковы причины возникновения миомы матки?
Самый важный аспект этиологии миомы матки – провоцирующий фактор роста опухоли – остаётся неизвестным, хотя теории её развития существуют. Одна из них — это нарушение гормонального фона у женщины (конкретно увеличение эстрогенов и прогестерона что приводит к повышению активности клеточного деления), однако не исключена и наследственная расположенность. Так же к возникновению миомы могут привести и воспалительные гинекологические заболевания, эндокринно-обменные заболевания (сахарный диабет, хронические заболевания внутренних органов, заболевания щитовидной железы), перенесённые внутриматочные вмешательства (аборты, выскабливания, использование внутриматочных спиралей).
Как влияет миома матки на зачатие?
Миома матки сама по себе не является причиной, препятствующей беременности и приводящей к бесплодию, однако женщинам с данным заболеванием бывает довольно непросто зачать ребенка. Всё зависит от количества, расположения и размеров миоматозного узла. Миома может сдавливать маточные трубы, деформировать их, тем самым нарушая процесс свободного движения сперматозоидов и, как следствие, оплодотворения. Так же миоматозный узел, если он находится в непосредственной близости от места имплантации, может нарушать её правильное течение и, как следствие, приводить к самопроизвольным выкидышам.
Небольшие узлы, находящиеся в мышечном слое матки, практически не влияют на процесс имплантации эмбриона. Как правило, в течение такой беременности осложнений не возникает.
Как миома влияет на беременность?
Небольшая миома во время беременности может протекать без каких-либо проявлений. Но бывают случаи и осложнений миом, и их влияния на течение самой беременности.
В 1 триместре миома может являться причиной угрожающего выкидыша, неразвивающейся беременности, кровотечения в результате отслойки плаценты, гипоплазии хориона, может отмечаться её рост.
Во 2 триместре она может быть причиной низкой плацентации, истмико-цервикальной недостаточности, фетоплацентарной недостаточности, что в свою очередь может привести к гипоксии и гипотрофии плода. Возможен рост миомы, нарушение её питания в следствие чего возникает некроз самого и узла и близлежащих тканей, представляя опасность и для жизни малыша, и для материнского организма.
В 3 триместре на фоне миомы возможно развитие таких осложнений как: неправильное предлежание и положение плода, плацентарная недостаточность, преэклампсия, угрожающие преждевременные роды. Подслизистые миомы, миомы расположенные ретроплацентарно и миомы объёмом более 200 см3 являются фактором риска отслойки плаценты и как следствие кровотечения, представляя угрозу для жизни матери и плода.
Роды и родоразрешение
В процессе родов миома может вызывать слабость родовой деятельности привести к её дискоординации , неправильное предлежание плода или создавать препятствие для прохождегние плода по родовым путям. Большая шеечная миома может осложнять роды через естестественные родовые пути, поэтому возникает необходимость в кесаревом сечении. Миома может нарушить сократительную способность миометрия, что может привести к атонии матки и послеродовому кровотечению. Миома расположенная в нижнем маточном сегменте может являться причиной задержки плаценты.
Итак, подводя итог, можно сделать вывод, что наступление беременности и благоприятное её разрешение при миоме матки возможно только при тщательном контроле состояния миоматозных узлов. Поэтому зная, что у вас есть данное заболевание, перед планированием беременности необходимо проконсультироваться с лечащим врачом. Ведь главное правило медицины: профилактика всегда лучше лечения, а лечение любого заболевания на ранней стадии всегда эффективнее борьбы с запущенным недугом.
Источник


