Миома матки в постменопаузе гормонотерапия

Комментарии
Опубликовано в :
Российский вестник акушера-гинеколога 3, 2012
Д.м.н., проф. Я.З. Зайдиева, д.м.н. М.А. Чечнева, к.м.н. О.С. Горенкова, В.А. Колесникова
Московский областной НИИ акушерства и гинекологии (дир. — акад. РАМН, проф. В.И. Краснопольский)
Hormonal therapy for climacteric disorders in postmenopausal women with uterine myom
Ya. Z. Zaidiyeva, M.A. Chechneva, O.S. Gorenkova, V.A. Kolesnikova, Moscow Regional Research Institute of Obstetrics and Gynecology
Проведено комплексное обследование (клиническое, лабораторное, УЗИ органов малого таза, цветовое допплеровское картирование) 21 пациентки с миомой матки малых размеров в постменопаузе, страдающей климактерическим синдромом, до проведения гормональной терапии и на ее фоне. Установлено, что у больных с миомой матки малых размеров в постменопаузе на фоне лечения климактерического синдрома ледибоном (тиболоном), объем матки и миоматозных узлов, а также параметры маточного и внутриопухолевого кровотоков остаются стабильными. Гормональная терапия ледибоном — высокоэффективный метод лечения климактерических расстройств, не оказывающий пролиферативного воздействия на эндометрий и миометрий у больных с миомой матки малых размеров в постменопаузе.
Ключевые слова: постменопауза, климактерический синдром, миома матки малых размеров, гормональная терапия, ледибон.
A comprehensive study (clinical, laboratory, small pelvic ultrasonography, color Doppler mapping) was made in 21 postmenopausal patients with climacteric disorders and small uterine myomas before and during hormonal therapy. The volume of the uterus and myomatous nodules and the parameters of uterine and intratumor blood flow were found to be unchanged in postmenopausal women with uterine myoma of small sizes during therapy for climacteric syndrome with ladybon. Hormonal therapy with this drug is a highly effective treatment for climacteric disorders, which exerts no proliferative effect on the endo-metrium and myometrium in postmenopausal patients with small uterine myoma.
Key words: postmenopause, small uterine myoma, hormonal therapy, ladybon.
Гормональная терапия (ГТ), эффективность которой доказана в крупных многоцентровых рандомизированных, плацебо-контролируемых исследованиях, широко используется при лечении климактерического синдрома (КС) у женщин [2, 11]. Вместе тем, существуют определенные ограничения для назначения половых гормонов женщинам в постменопаузе с КС и различными гинекологическими заболеваниями [1, 4, 12]. В частности, вопрос — использовать ли ГТ у больных с миомой матки — до настоящего времени остается дискуссионным [3, 6, 13].
Согласно данным литературы [5, 8, 10], на фоне проведения ГТ стандартными дозами имеется риск роста ми-оматозных узлов, что ограничивает применение данной терапии у больных с миомой матки.
Поскольку распространенность миомы матки среди женщин в постменопаузе составляет 10—15%, оценка безопасности ГТ в данной когорте пациенток имеет большое значение для клинической практики [7, 9, 14].
Таким образом, ряд нерешенных вопросов и высокая распространенность миомы матки у женщин в постменопаузе делает актуальной проблему разработки клинико-диагностических критериев, на основании которых будут обоснованы принципы дифференцированного подхода к назначению ГТ, предназначенной для коррекции климактерических расстройств у больных в постменопаузе с миомой матки малых размеров.
Материал и методы
Основу работы составили результаты комплексного клинико-лабораторного и инструментального обследования и лечения 21 женщины с КС и миомой матки малых размеров в постменопаузе, возраст которых колебался от 40 до 65 лет (53,8±5,2 года), а длительность постменопаузы — более 1 года.
На этапе отбора пациенток был тщательно проанализирован анамнез, исключены противопоказания к ГТ.
Учитывая направленность воздействия препаратов, применяемых в качестве ГТ в постменопаузе, проводили исследование гормонального профиля больных до лечения и на фоне лечения.
Программа обследования пациенток включала общеклиническое и гинекологическое обследование, оценку гормонального статуса: определение содержания ФСГ, ЛГ, Е2, ПРЛ, ТТГ в периферической крови радиоиммунологическим методом. УЗИ органов малого таза в сочетании с цветовым допплеровским картированием и допплерометрией сосудов матки и внутриопухолевых сосудов осуществляли c использованием мультичастотного трансвагинального датчика на аппаратах ACCUVIX V-20, V-10 и MEDI-SON. Для определения объема тела матки и узлов лейомиомы производили вычисление по предложенной G. Healy (1989) формуле для эллипсоидных опухолей, включающей данные ультразвукового сканирования, с определением (в см) продольного, поперечного и переднезаднего размеров (R. Shaw, 1998). Для изучения состояния гемодинамики матки предпочтительным считался трансвагинальный доступ, проводили допплерометрическое измерение кривых скоростей кровотока (КСК) по стандартной методике. Проводилось измерение показателей в правой и левой маточной артериях, а также в артериях, кровоснабжающих миоматозный узел (или наибольший из миоматозных узлов при множественной миоме матки).
Исходно объем тела матки не превышал 43,1±18,2 см3. Количество миоматозных узлов колебалось от 1 до 3, диаметр миоматозных узлов варьировал от 0,5 до 3,0 см, а объем наибольшего не превышал 3,7±2,7 см3, 2/3 узлов являлись субсерозными, 1/3 — узлами, расположенными межмышечно. Большинство узлов были гипоэхогенными по структуре.
Для оценки клинических проявлений КС в исследовании использовали оценочную шкалу его симптомов The Greene Climacteric Scale, разработанную в 1998 г. проф. J. Greene, которая позволяет определить степень выраженности каждого из симптомов отдельно, оцененную в баллах. У всех пациенток оценка выраженности КС проводилась в динамике, т.е. до и на фоне проводимой терапии (через 12 мес).
Показанием для назначения гормональной терапии (Ледибон) явилось наличие климактерических расстройств у женщин в постменопаузе.
Среди широкого спектра лекарственных средств, предназначенных для гормональной терапии климактерических расстройств у женщин в постменопаузе, при наличии у больных миомы матки малых размеров рекомендуется назначение ледибона (тиболона) в таблетках 2,5 мг. В отличие от других препаратов, применяемых для ГТ, ледибон представляет собой молекулу гестагена, относящегося к классу норстероидов. При приеме внутрь ледибона образуются три метаболита (3ct-OH-tibolone,3P-OH-tibolone, А4-изомер), которые избирательно связываются с андрогенными, прогестероновыми и эстрогенными рецепторами в тканях-мишенях. Так, А4-изомер связывается в матке только с рецепторами прогестерона, оказывая антипролиферативный эффект.
Согласно дизайну исследования контроль эффективности и безопасности лечения больных осуществляли при динамическом обследовании пациенток исходно и через 12 мес.
Статистический анализ полученных данных производили с использованием статистического пакета прикладных программ Statistica for Windows v. 6.0, Stat Soft Inc (США).
Результаты и обсуждение
Длительность постменопаузы у обследованных больных в среднем составила 3,3±1,5 года. Количество миоматозных узлов колебалось от 1 до 3, объем доминантного узла в среднем составлял 3,7±2,7 см3.
Длительность климактерического синдрома в среднем составила 4,8±3,0 года, при этом у 2 пациенток отмечено атипическое течение КС в течение 10 лет.
У всех пациенток были жалобы на нейровегетативные нарушения (приливы «жара», ночную потливость, головные боли), психоэмоциональные расстройства (депрессия, раздражительность, изменение ритма сна, плаксивость, слабость, нарушение концентрации внимания), нарушения со стороны урогенитального тракта (диспареуния, атрофические вагиниты) различной степени выраженности, снижение либидо. Наиболее частыми жалобами были приливы «жара», потливость, головные боли, повышенная утомляемость, изменение настроения, снижение работоспособности, ухудшение памяти.
Длительность заболевания, по первому посещению, при котором был установлен диагноз миомы матки малых размеров, была в среднем 10,9±6,5 года.
На момент обследования перед началом лечения у всех больных (n=21) менструации отсутствовали от 1 года до 5 лет; ни в одном случае не выявлено сопутствующих гинекологических заболеваний, за исключением миомы матки малых размеров.
Анализ результатов лечения проводился на основании клинических, лабораторных и инструментальных методов обследования. Оценивалось влияние терапии на симптомы КС, гормональный профиль, содержание биохимических показателей в плазме крови, показатели гемостаза и клинического анализа крови, а также характер ответной реакции органов-мишеней, и, в частности, миомы матки — по ультразвуковым биометрическим параметрам и допплерометрическим показателям кровотока в артериях матки и миоматозных узлов.
При анализе клинических данных распределения женщин по степени тяжести КС, согласно оценке по шкале J. Greene, установлено, что у 54% больных имела место тяжелая степень, у 28% — средняя степень тяжести и только в 18% случаев — легкие клинические проявления КС. Средний показатель для всей группы исходно составил 21,9±8,3 балла. Через 12 мес приема Ледибона средний показатель снизился до 8,6±1,7 баллов.
Уже к концу 6-го месяца терапии значительно снизилась частота и интенсивность приливов «жара», уменьшилась потливость, достигнув 90%, отмечено достоверное улучшение сна у каждой второй пациентки и полное отсутствие нарушений сна у другой половины обследованных (р<0,05). Уменьшились симптомы со стороны центральной нервной системы — слабость, головокружение, снижение эмоционального фона, депрессия, раздражительность; трофические изменения в урогенитальном тракте, наблюдавшиеся до лечения у каждой четвертой пациентки и проявляющиеся диспареунией после 6 мес лечения, уменьшились наполовину. Через 12 мес терапии указанная выше положительная динамика сохранялась. Клиническая эффективность лечения климактерических расстройств у женщин с миомой матки малых размеров в постменопаузе тиболоном (ледибоном) составила 83%.
Таким образом, достигнутые результаты лечебного эффекта убедительно свидетельствуют об эффективности ледибона в нормализации общего состояния больных, повышении качества жизни женщин в постменопаузе. Анализ клинических данных на фоне лечения ледибоном показал отсутствие и кратковременность выраженных побочных эффектов и хорошую переносимость препарата.
Наряду с вышеуказанными положительными изменениями клинического состояния больных получены объективные данные лабораторных и инструментальных исследований, подтверждающие отсутствие отрицательного влияния ГТ на органы-мишени: ни в одном случае роста узлов миомы не выявлено.
Полученные результаты гормонального обследования до лечения показали, что у всех больных имелись однотипные изменения содержания половых гормонов, характерные для периода постменопаузы: повышенный уровень ФСГ (80,7±33,0 МЕ/л), а также сниженный уровень эстрадиола (в среднем 27,25±14,8 пмоль/л).
На фоне проводимой терапии имелась тенденция к снижению уровня ФСГ (64,8±22,2 МЕ/л) и достоверное повышение уровня эстрадиола (78,3±12,1 пмоль/л). Содержание всех остальных исследуемых гормонов не выходило за рамки возрастных нормативных значений как до, так и на фоне 1 года лечения.
Также произведена оценка содержания яичникового онкомаркера СА-125, уровень которого не превышал нормативного значения (в среднем 7,5±1,6 ед/мл). При контроле гормональных показателей и онкомаркера СА-125 через 12 мес лечения значимых изменений не отмечено (7,1±1,2 ед/мл).
Полученные результаты показателей биохимического и клинического анализов крови, а также показателей гемостаза как до, так и через 12 мес после лечения свидетельствуют об отсутствии отрицательного влияния на данные показатели.
Контроль за состоянием органов малого таза (в том числе эндометрия, матки и миомы) осуществлялся у всех больных до начала лечения ледибоном и спустя 12 мес после его начала. В процессе первичного обследования и динамического наблюдения вычислялись размеры и объем матки, доминантного миоматозного узла, яичников, срединного М-эха (табл. 1).
Таблица 1. Эхографические показатели органов малого таза до начала терапии и через год на фоне ее проведения у обследованных больных
Показатель | До лечения | Через 12 мес |
Матка, V, см3 | 43,1±18,2 | 42,1±16,8 |
Миоматозный узел, V, см3 | 3,7±2,7 | 3,2±2,6 |
Эндометрий, М-Эхо, см | 0,21±0,12 | 0,34±0,11 |
Правый яичник, V, см3 | 1,74±0,8 | 1,98±0,9 |
Левый яичник, V, см3 | 2,19±0,6 | 2,4±0,7 |
Согласно полученным результатам, у всех обследованных пациенток до начала лечения отражение эндометрия (М-эхо) колебалось от «линейного» до 0,5 см, т.е. соответствовало возрастной норме при отсутствии патологических очагов гиперэхогенности. Картина яичников характеризовалась уменьшением их размеров и отсутствием фолликулярного аппарата у всех обследованных пациенток. Описанные изменения в яичниках являются характерными для женщин в постменопаузе.
Динамическое наблюдение за состоянием органов малого таза не выявило различий в размерах матки и яичников, толщины эндометрия по сравнению с исходными данными. Как средний показатель толщины эндометрия, так и индивидуальные значения находились в рамках нормальных показателей и соответствовали периоду постменопаузы. Структурных изменений и изменений в размерах яичников за период наблюдения не отмечено. Объем доминантного миоматозного узла существенно не менялся. Полученные нами результаты согласуются с данными других авторов [8, 9].
В целях визуального контроля безопасности лечения при динамическом наблюдении детальному изучению допплерографических параметров подвергались доминантные миоматозные узлы и восходящие ветви маточных артерий. При проведении исследований с помощью цветовой допплерографии, несмотря на то что миоматозные узлы изменяли сосудистую архитектуру матки, кровоток во внутриматочных сосудах можно было определить как умеренный у 100% больных. Допплерометрические показатели периферического сосудистого сопротивления (ПСС), пульсационного индекса (ПИ) и индекса резистентности (ИР) в восходящих ветвях маточных артерий у всех больных не отличались от исходных значений при незначительном нарастании сосудистого сопротивления в маточных артериях. Значения показателей ПИ и ПСС в миоматозных узлах не претерпели значимых изменений в сравнении с исходными показателями (табл. 2).
Таблица 2. Допплерометрические показатели кровотока в маточных артериях и сосудах миоматозных узлов до начала лечения и через год после его начала у обследованных больных
До лечения | Через 12 мес | |
Правая маточная артерия | 20,1±12,8 | |
ПСС, см-5/с | 20,45±13,3 | 5,0±2,26 |
ПИ | 4,95±2,24 | 0,8±0,07 |
ИР | 0,77±0,07 | |
Левая маточная артерия | 21,8±11,3 | |
ПСС, см-5/с | 22,5±11,5 | 6,4±4,23 |
ПИ | 6,25±4,2 | 0,78±0,3 |
ИР | 0,74±0,28 | |
Артерия, питающая лейомиому | ||
ПСС, см-5/с | 13,25±4,46 | 13,1±3,42 |
ПИ | 2,63±1,16 | 2,9±1,1 |
ИР | 0,92±0,75 | 0,95±0,6 |
Таким образом, анализ эхографических и допплерографических показателей, полученных при обследовании больных до гормональной терапии ледибоном и на ее фоне, свидетельствует об отсутствии отрицательного влияния препарата на объем матки и миоматозных узлов, параметры кровоснабжения матки и узлов, а также интенсивность кровотока в миоматозных узлах при клиническом успехе ГТ в отношении климактерических расстройств.
Выводы
1. Результаты комплексного обследования пациенток с миомой матки малых размеров в постменопаузе на фоне ГТ ледибоном (тиболоном) с использованием УЗИ, цветового допплеровского картирования для оценки состояния матки и миоматозных узлов, маточного и внутриопухолевого кровотоков дают основание рассматривать ГТ как высокоэффективное лечебное средство, не оказывающее пролиферативного воздействия на эндометрий и миометрий у больных с миомой матки малых размеров в постменопаузе.
2. Полученные результаты позволили расширить возможность проведения гормональной терапии для коррекции климактерических расстройств у пациенток с миомой матки малых размеров в постменопаузе.
ЛИТЕРАТУРА
1. Кулаков В.И., Уварова Е.В. Гормональная реабилитация женщин при выпадении функции яичников. Пособие для врачей. Под ред. В.И. Кулакова. М 2000; 23.
2. Сметник В.П. Медицина климактерия. Под ред. В.П. Сметник. Ярославль: ООО Изд-во Литера 2006; 848.
3. Archer D.F. Endometrial bleeding during hormone therapy: The effect of progestogens. Maturitas 2007; 57: 71—76.
4. Bergeron C., Ferenczy A. Endometrial safety of continuous combined hormone replacement therapy with 17|3-oestradiol (1 or 2 mg) and dydrogesterone. Maturitas 2001; 37: 191—199.
5. Bodner-Adler B. Expression of p16 protein in patients with uterine smooth muscle tumors: an immunohistochemical analysis. Gynec Oncol 2005; 96: 1: 62—66.
6. Cardoso E.B. et al. Transvaginal Doppler sonography: is it advantageous in the differentiation of endometrial lesions. Obstet Gynec Infertility 2007; 65.
7. Cesausu I. et al. Pipelle and direct hysteroscopic biopsy in evaluation of the endometrium in postmenopause. Maturitas 2006; 5: 4: Suppl 1: 13—16.
8. Dixon D., Flake G.P., Moore A.B., He H., Haseman J.K., Risinger J.I., Lancaster J.M., Berchuck A., Barrett J.C., Robboy S.J. Cell proliferation and apoptosis in human uterine leiomyomas and myometria. Virchows Arch 2002; 441: 53—62.
9. Luoto R., Kaprio J., Rutanen E.M., Taipale P., Perola M., Kosken-vuo M. Heritability and risk factors of uterine fibroids — the Finnish Twin Cohort study. Maturitas 2000; 37: 15—26.
10. Magali A. A dynamic shift of VEGF isoforms with a transient and selective progesterone-induced expression of VEGF189 regulates angiogenesis and vascular permeability in human uterus. Cell biology. PNAS 2002; 99: 9: 6023—6028.
11. Pines A. Postmenopausal hormone therapy: the way ahead. Maturitas 2007; 57: 1: 3—5.
12. Sturdee D.W. Endometrial cancer and HRT. Reviews. Gynecolog Pract 2005; 5: 51—56.
13. Sitruk — Ware R. New progestogens: a review of their effects in perimenopausal and postmenopausal women. Drugs Aging 2004; 21: 13: 865—883.
14. Van de Weijer P.H., Mattsson L.A., Ylikorkala O. Benefits and risks of long-term low-dose oral continuous combined hormone therapy. Maturitas 2007; 56: 3: 231—248.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
С прекращением менструаций вероятность роста доброкачественной мышечной опухоли снижается. Миома матки в менопаузе не требует хирургического лечения – чаще всего надо регулярно наблюдать за узлами, особенно в первые годы климакса.
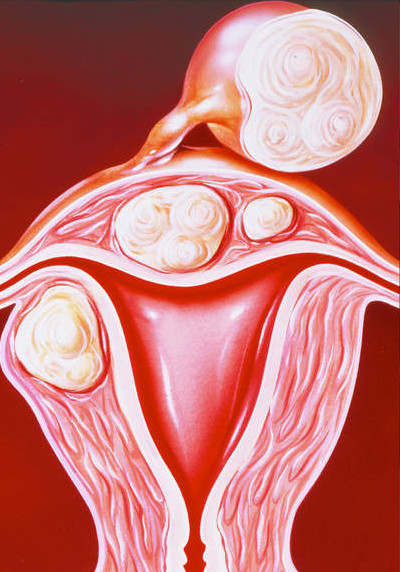
Наличие узлов в матке в менопаузе является основанием для врачебного наблюдения
Миома матки в менопаузе – каков риск роста узлов
Завершение репродуктивных процессов в яичниках, происходящее у женщин в возрасте 45-55 лет, приводит к климаксу. Имеющаяся миома матки в менопаузе постепенно регрессирует (уменьшается в размерах), но наличие доброкачественного мышечного новообразования требует врачебного наблюдения в первые годы перименопаузы. Начало климакса – это время выраженных гормональных колебаний, на фоне которых могут возникнуть проблемы со стороны матки. Рост миоматозного узла в первые годы прекращения месячных возможен, поэтому необходимо регулярно наблюдаться у доктора и делать УЗИ 1 раз в полгода. Через 3-4 года менопаузы при отсутствии негативных симптомов можно обследоваться 1 раз в год.
Лечебная тактика в перименопаузе
Гормональные расстройства, типичные для начала климакса, могут спровоцировать следующие проблемы в женском организме:
- Изменение апоптоза (снижение защитных факторов, предотвращающее опухолевый рост);
- Возникновение новых очагов пролиферации в матке (гиперплазия эндометрия, появление новых узлов, рост имеющейся лейомиомы);
- Общие эндокринные нарушения, оказывающие негативное влияние на матку и яичники;
- Редкие, но обильные маточные кровотечения, приводящие к анемии и общему ослаблению организма.
Миома матки в менопаузе требует лечения, особенно в период начавшихся перименопаузальных нарушений, когда редко приходящие критические дни на фоне эндокринных расстройств могут спровоцировать увеличение размера узлов и перерождение клеток эндометрия. Основа лечебной тактики – медикаментозная терапия: врач назначит лекарственные препараты, которые помогут без осложнений пережить начало климакса. Показаниями для хирургического удаления матки являются:
- обильные анемизирующие кровотечения, которые невозможно вылечить лекарствами;
- рост миоматозных узлов;
- формирование множественной лейомиомы матки;
- подозрение на злокачественное перерождение.
В большинстве случаев можно избежать хирургического вмешательства – при правильном подходе к выбору лечебной тактики женщина уходит в менопаузу с сохраненной маткой.

При правильно выбранной тактике лечения миомы матки в менопаузе нет необходимости в операции
Наблюдение в постменопаузе
По мере увеличения возраста климакса в матке происходят определенные изменения, снижающие вероятность осложнений. Миома матки в менопаузе постепенно изменяется, что проявляется следующими процессами:
- Гипотрофия мышечных клеток;
- Разрастание фиброзной ткани;
- Уменьшение размера миоматозных узлов;
- Атрофия тканей.
Постепенный регресс мышечной опухоли объясняется снижением процессов пролиферации и увеличением уровня апоптоза клеток: риск опасных для жизни и здоровья изменений в матки нивелируется, что является основанием для прекращения постоянного наблюдения за узлами.
Миома матки в менопаузе – риск применения гормонотерапии
В климаксе у женщины возникает множество крайне неприятных симптомов, которые можно лечить с помощью заместительной гормонотерапии (ЗГТ), но использование сильных препаратов на фоне имеющейся лейомиомы может стать причиной следующих осложнений:
- Увеличение размеров узла за счет эндокринной стимуляции опухоли;
- Появление новых мышечных новообразований (множественная форма заболевания);
- Стимулирование клеточной пролиферации в гормоночувствительных органах (матка, яичники, молочная железа).
ЗГТ может стать причиной прекращения регресса миоматозных узлов, поэтому миома матки в менопаузе является относительным противопоказанием для гормонотерапии. Лекарственные препараты для ЗГТ могут применяться у женщин в постменопаузе в следующих случаях:
- наличие не более 2 узлов, размеры которых не превышают 3 см в диаметре;
- удаленная матка (состояние после гистерэктомии).
В любом случае применение гормонотерапии у женщин с миомой требует регулярного УЗ контроля (не реже 1 раза в 6 месяцев).
При отсутствии серьезных осложнений в первые годы климакса, миома матки в менопаузе не оказывает негативного влияния на здоровье женщины. По мере погружения в постменопаузу (через 7-10 лет) можно постепенно забыть даже о множественной миоме матки и о миоматозных узлах, инволюция которых завершается, а риск осложнений снижается до минимальных значений (в 1% случаев миома матки может перерасти в рак).
Источник

