Псаммомные тельца в кисте яичника

Большой медицинский словарь . 2000 .
Смотреть что такое “псаммозные тельца” в других словарях:
Тельца Псаммозные (Acervulus Cerebri) — кальцийсодержащие гранулы, которые иногда можно обнаружить внутри шишковидного тела в процессе его затвердевания (обычно после семнадцати лет): мозговой песок . Источник: Медицинский словарь … Медицинские термины
ТЕЛЬЦА ПСАММОЗНЫЕ — (acervulus cerebri) кальцийсодержащие гранулы, которые иногда можно обнаружить внутри шишковидного тела в процессе его затвердевания (обычно после семнадцати лет): мозговой песок … Толковый словарь по медицине
псаммомные тельца — см. Псаммозные тельца … Большой медицинский словарь
Псаммо́мные тельца́ — см. Псаммозные тельца … Медицинская энциклопедия
ПСАММОМА — (от греч. psaramos песок), опухоль, несущая в себе очаги объизвествления,или т. н. псаммозные тельца (см. Corpora arenacea). Т. к.опухоли с указан, тельцами бывают самой разнообразной природы в смысле гистогенеза, какого: раки (теапр. яичников),… … Большая медицинская энциклопедия
псаммома — (psammoma; псамм + ома; син. ацервулома) общее название опухолей, в ткани которых обнаруживают псаммозные тельца … Большой медицинский словарь
Псаммо́ма — (psammoma; Псамм + ома; син. ацервулома) общее название опухолей, в ткани которых обнаруживают псаммозные тельца. Псаммома яичника злокачественная (р. ovarii malignum) см. Кистома яичника цилиоэпителиальная малигнизированная (Кистома яичника) … Медицинская энциклопедия
Псаммома (Psammomd) — опухоль, содержащая мелкие, напоминающие по внешнему виду песок, частицы (псаммозные тельца (psammoma bodies)). Образование этой опухоли часто встречается при раке яичников, однако иногда она может развиваться и в мозговых оболочках (оболочках,… … Медицинские термины
ПСАММОМА — (psammomd) опухоль, содержащая мелкие, напоминающие по внешнему виду песок, частицы (псаммозные тельца (psammoma bodies)). Образование этой опухоли часто встречается при раке яичников, однако иногда она может развиваться и в мозговых оболочках… … Толковый словарь по медицине
1. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991—96 гг. 2. Первая медицинская помощь. — М.: Большая Российская Энциклопедия. 1994 г. 3. Энциклопедический словарь медицинских терминов. — М.: Советская энциклопедия. — 1982—1984 гг .
Смотреть что такое “Псаммозные тельца” в других словарях:
псаммозные тельца — (corpora psammosa; син. псаммомные тельца) микроскопические шарообразные слоистые образования, возникающие вследствие выпадения в тканях белково липидных субстанций, подвергающихся инкрустации солями кальция; П. т. встречаются, как правило, в… … Большой медицинский словарь
Тельца Псаммозные (Acervulus Cerebri) — кальцийсодержащие гранулы, которые иногда можно обнаружить внутри шишковидного тела в процессе его затвердевания (обычно после семнадцати лет): мозговой песок . Источник: Медицинский словарь … Медицинские термины
ТЕЛЬЦА ПСАММОЗНЫЕ — (acervulus cerebri) кальцийсодержащие гранулы, которые иногда можно обнаружить внутри шишковидного тела в процессе его затвердевания (обычно после семнадцати лет): мозговой песок … Толковый словарь по медицине
псаммомные тельца — см. Псаммозные тельца … Большой медицинский словарь
Псаммо́мные тельца́ — см. Псаммозные тельца … Медицинская энциклопедия
ПСАММОМА — (от греч. psaramos песок), опухоль, несущая в себе очаги объизвествления,или т. н. псаммозные тельца (см. Corpora arenacea). Т. к.опухоли с указан, тельцами бывают самой разнообразной природы в смысле гистогенеза, какого: раки (теапр. яичников),… … Большая медицинская энциклопедия
псаммома — (psammoma; псамм + ома; син. ацервулома) общее название опухолей, в ткани которых обнаруживают псаммозные тельца … Большой медицинский словарь
Псаммо́ма — (psammoma; Псамм + ома; син. ацервулома) общее название опухолей, в ткани которых обнаруживают псаммозные тельца. Псаммома яичника злокачественная (р. ovarii malignum) см. Кистома яичника цилиоэпителиальная малигнизированная (Кистома яичника) … Медицинская энциклопедия
Псаммома (Psammomd) — опухоль, содержащая мелкие, напоминающие по внешнему виду песок, частицы (псаммозные тельца (psammoma bodies)). Образование этой опухоли часто встречается при раке яичников, однако иногда она может развиваться и в мозговых оболочках (оболочках,… … Медицинские термины
ПСАММОМА — (psammomd) опухоль, содержащая мелкие, напоминающие по внешнему виду песок, частицы (псаммозные тельца (psammoma bodies)). Образование этой опухоли часто встречается при раке яичников, однако иногда она может развиваться и в мозговых оболочках… … Толковый словарь по медицине
ПСАММОЗНЫЕ ТЕЛЬЦА (греч. psammos песок; син.: песчаные тельца, corpora arenacea) — мелкие шаровидные слоистые образования, состоящие из солей кальция. П. т. обнаруживают в соединительной ткани сосудистых сплетений желудочков и паутинной оболочке головного мозга, во внутренних слоях твердой оболочки головного и спинного мозга, шишковидном теле (эпифизе), а также в различных опухолях — фиброме, менингиоме, фибросаркоме, кистах яичников и др.
Внутриклеточное образование П. т. происходит в основном в папиллярных опухолях щитовидной железы (см.) и яичников (см.), арахноидэндотелиоме (см. Менингиома) и пинеаломе (см.). Наличие П. т. в эпителиальных опухолях щитовидной железы и яичников многие исследователи считают одним из признаков их малигнизации. В шишковидном теле П. т. в виде так наз. мозгового песка (acervulus cerebralis) обнаруживаются в гиалинизированной соединительной ткани стенок артериол. При хронических гнойных процессах в мозговых оболочках содержание в них П. т. часто значительно возрастает.
Образование П. т. связано с процессами кальцификации, происходящими в клетках и строме (см. Кальциноз). Матрицей обызвествления могут быть гликозаминогликаны основного вещества, коллагеновые и эластические волокна соединительной ткани. Начальные этапы образования П. т. в клетках связаны с отложением солей кальция на кристах митохондрий, в структурах эндоплазматической сети и тонофибриллах.
П. т. иногда определяются макроскопически как плотные зернистые образования белесоватого цвета. При гистол, исследовании П. т. имеют сферическую форму, иногда напоминают колбы, иглы, шипы и состоят из концентрических чередующихся базофильных структур (рис.), интенсивность окраски которых может быть различной. П. т. отчетливо окрашиваются реактивом Шиффа (см. Шиффа реактив) и дают положительную реакцию на известь по методу Коссы (см. Коссы способы). По периферии П. т. нередко развивается воспалительная реакция, при этом в составе инфильтрата обнаруживают множество гистиоцитов и гигантских многоядерных клеток. Электронномикроскопически в клетках выявляют сливающиеся кальцификаты, постепенно заполняющие всю цитоплазму или образующие сферические структуры в строме. В результате преципитации микрокристаллов образуется слоистая структура П. т. Рентгеноструктурный анализ свидетельствует об апатитоподобном строении П. т.
Библиография: Козловский О. М. и др. К вопросу о механизме образования псаммозных телец в серозных аденокарци-номах яичников, Арх. патол., т. 40, № 2, с. 25, 1978; Серов В. В. и Пауков В. С. Ультраструктурная патология, с. 217, М., 1975; Струков А. И. и Серов В. В. Патологическая анатомия, с. 47, М., 1979.
Post Views:
38
Источник
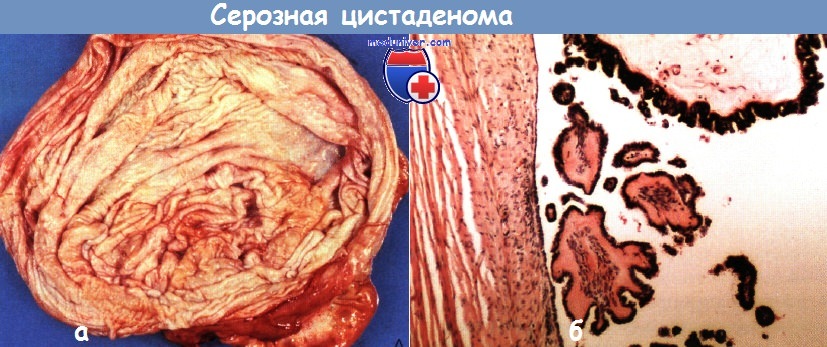
Доброкачественные эпителиальные опухоли яичников. Цистаденома яичников.Среди доброкачественных эпителиальных опухолей серозные и муцинозные опухоли являются наиболее частыми. Они составляют более половины всех доброкачественных новообразований яичников, встречаются в любом возрасте. Серозные опухоли наблюдают чаще муцинозных и обнаруживают преимущественно в возрасте 30—55 лет, а муцинозные—в 40—60 лет. Серозная цистаденома чаще бывает односторонняя, однокамерная и, как правило, гладкостенная. Величина ее 3—30 см. Содержимое—прозрачная серозная жидкость соломенного цвета. Выстилающий стенку эпителий однорядный кубический или уплощенный, реже цилиндрический. Мерцательный эпителий наблюдают лишь местами. Капсула опухоли в основном плотноволокнистая. Грубососочковая цистаденома (кистома). На ее внутренней поверхности обнаруживают плотные сосочковые образования и бляшки, массивная плотная соединительнотканная основа которых нередко находится в состоянии отека или гиалиноза. Эпителий, покрывающий эти сосочки и бляшки, тот же, что и выстилающий эпителий цилиоэпителиальной кистомы. Папиллярная цистаденома (кистома) чаще бывает многокамерная. Характерно наличие мягких сосочковых разрастаний, которые, заполняя одну или многие камеры опухоли, напоминают по виду цветную капусту. В других наблюдениях они представлены небольшим количеством бородавчатых разрастаний. При наличии известковых отложений папиллярные образования отличаются значительной плотностью. Величина папиллярных кистом сравнительно небольшая. Они чаще, чем цилиоэпителиальные кистомы, бывают двусторонними. Их жидкое содержимое то желтоватого, то коричневатого цвета. Очень часто папиллярные разрастания обнаруживают не только на внутренней, но и на наружной поверхности кистозной опухоли. Многочисленные сосочки в папиллярных кистомах имеют то сравнительно тонкую, насыщенную клетками и кровеносными сосудами, то большей толщины соединительнотканную основу. Эпителиальный покров сосочков однорядный, отличается особенно большим сходством с трубным эпителием. В строме сосочков, реже в стенке кистомы обнаруживают псаммомные тельца. Поверхностная папиллома встречается редко. Микроскопически она представляет собой опухоль папиллярного строения, чаще двустороннюю, обычно большого размера, расположенную на поверхности яичника и иногда полностью окутывающую его. Типичная поверхностная папиллома характеризуется теми же особенностями строения, что и папиллярная кистома. В дифференциально-диагностическом отношении необходимо учитывать микропапиллоз (микропапилломатоз, бородавчатый яичник), который встречается чаще у пожилых женщин. При микропапиллозе сосочки обычно очень мелкие, не ветвящиеся, располагаются на поверхности яичника в виде небольших очаговых скоплений, покрытых сочным мезотелием.
Серозная аденофиброма, как цистаденофиброма, относится к числу сравнительно редких опухолей. Иногда она представляет собой фиброзно-измененный яичник, иногда мелкая аденофиброма (0,1-0.3 см) располагается в корковом слое. В отдельных наблюдениях небольшие опухоли имеют толстую ножку, которая соединяет их с поверхностью яичника. Однако чаще аденофиброма сочетается с кистозными образованиями (серозная цистаденофиброма). Такие опухоли бывают небольшой величины, реже достигают 20 см. Плотная часть опухоли построена по типу фибромы, в которой наблюдают железистые включения, местами резко расширенные и выстланные кубическим зиителием: выстилающий эпителий кистозных образований бывает цилиндрическим, нередко реснитчатым. В некоюрых цистаденофибромах обнаруживают плотные сосочковые образования и бляшки, микроскопически имеющие сходство с таковыми в грубососочковой кистоме. но с включением в соединительнотканной основе их железистых структур. Среди муцинозных опухолей можно выделить 3 основные группы. К 1-й из них относятся муцинозные опухоли, большинство которых возникает из мюллерова они гелия. Ко 2-й группе относятся те муцинозные кистомы, которые сочетаются с опухолями Бреннера. Источником происхождения 3-й группы муцинозных опухолей (примерно 5-6% всех муцинозных опухолей) является энтодермальный эпителий кишечного типа. О тератоидном генезе их свидетельствует наличие в них бокаловидных и энтерохромаффинных клеток. Муцинозная цистаденома является наиболее простой формой муцинозных опухолей [отсюда и название простая (сецернирующая) муцинозная кистома]. Она встречается наиболее часто, преимущественно односторонняя; двустороннее поражение наблюдают примерно в 10% случаев. Имеет величину 15-30 см, изредка 50 см. Опухоль округлая или овоидная, в большинстве случаев многокамерная. Содержимое различной величины камер обычно желеобразное. Внутренняя поверхность их гладкая, выстлана однорядным высоким цилиндрическим эпителием, сходным с эпителием слизистой оболочки цервикального канала. Митозы не обнаруживаются. Для эпителия муцинозных цистаденом характерна способность к образованию слизи (муцина). Муцин располагается в клетках в виде мелких капелек и выявляется при окраске муцикармином, альциановым синим и IIIИК-методом. Наряду с указанным эпителием иногда обнаруживают кубический, местами уплощенный, а в отдельных наблюдениях и цилиндрический эпителий типа трубного диморфная муцинозно-серозная цистаденома). «Псевдонапиллярная» муцинозная цистаденома чаще бывает односторонняя многокамерная, иногда с наличием компактных участков. Гистологически «псевдонаниллярные» муцинозные кистомы представляют собой ту же простую муцинозную кистому с наличием картин ложнососочкового строения. Папиллярную муцинозную цистаденому наблюдают реже псевдопапиллярной муцинозной, более чем в половине случаев она бывает двусгоронняя. На внутренней поверхности камер кистомы обнаруживают сосочковые разрастания, иногда напоминающие но виду цветную капусту. Сосочки имеют соединительнотканную основу. Эпителиальный покров сосочков при доброкачественном варианте муцинозных кистом однорядный. Высота и форма клеток может варьировать: наряду с высоким цилиндрическим эпителием наблюдают кубические и бокаловидные клетки; можно встретить высокие узкие клетки с вытянутыми ядрами и небольшим количеством цитоплазмы в виде ободка. Иногда отмечают нарушения в процессе слизеобразования: некоторые клетки теряют способность продуцировать слизь, цитоплазма других клеток переполнена капельками муцина. Муцинозная аденофиброма встречается редко, состоит из двух компонентов: ткани типа фибромы и железистых включений или мелких кист, выстланных высоким цилиндрическим эпителием. Из мелких кист могут развиваться крупные полостные образования, выстланные тем же эпителием, муцинозная цистаденофиброма. Серьезным, хотя и редким, осложнением муцинозных опухолей яичников является псевдомиксома брюшины. Одним из механизмов развития ее является пропитывание слизью стенки муцинозной цистаденомы с последующим некрозом и разрывом. Излитие желеобразного содержимого в брюшную полость вместе с опухолевыми фрагментахми и ведет к имплантации последних на брюшине. При наличии у одной и той же больной муцинозной опухоли яичника и мукоцеле червеобразного отростка трудно определить, является ли опухоль или мукоцеле, или и то и другое, первичной локализацией поражения. В подобных случаях, руководствуясь практическими целями, опухоль яичника рекомендуют рассматривать как первичную, отмечая поражение аппендикса как дополнительное. При воспалительных явлениях в стенке кистозной опухоли можно наблюдать псевдоксантомные клетки; их необходимо дифференцировать от очаговых скоплений лютеинизированных стромальных клеток. Они имеют овальную и полигональную форму, светлую или эозинофильную цитоплазму и небольшое ядро. Эти клетки изредка встречаются в доброкачественных, пролиферирующих и злокачественных опухолях, чаще в серозных и муцинозных. Лютеинизированные стромальные клетки — энзиматически активные клетки, содержат линиды, принимают участие в биосинтезе стероидов, обладают эндокринной, в частности, эстрогенной активностью; об этом свидетельствуют и маточные кровотечения у подобных больных, диффузные и очаговые гиперпластические процессы эндометрия и пролиферативные изменения трубного эпителия у большинства таких женщин. Новообразования подобного рода, именуемые в литературе как «опухоли с функционирующей стромой», могут продуцировать не только эстрогены, но и андрогены. — Также рекомендуем «Светлоклеточные опухоли яичников. Опухоль Бреннера.» Оглавление темы «Опухоли яичников.»: |
Источник
История изучения пограничных опухолей яичников (ПОЯ) насчитывает уже около 100 лет, однако многие вопросы до настоящего времени не находят своего ответа. Впервые ПОЯ были описаны в 1929 г. гинекологом из США Говардом Тэйлором [1]. Он назвал эти опухоли «полузлокачественными», подчеркивая тем самым особенности их клинического течения, существенно отличающегося как от классического рака яичников, так и от доброкачественных образований.
В структуре неоплазий яичников доля пограничных опухолей составляет около 10—15%, показатели заболеваемости варьируют в различных странах от 1,8 до 4,8‰. ПОЯ развиваются из поверхностного эпителия яичников и кист-включений. С морфологических позиций эти новообразования характеризуются умеренно выраженными пролиферативной и митотической активностью, стратификацией эпителия, ядерной и клеточной атипией. Принципиальным отличием пограничных опухолей от рака яичников является отсутствие стромальной инвазии и характерного для аденокарцином инфильтративного деструктивного роста. Именно эти морфологические характеристики ПОЯ предопределяют их особенное положение в спектре биологической агрессивности опухолей яичников [2, 3].
Соответственно различным видам эпителия, представленного в женской половой системе, выделяют следующие гистологические типы пограничных опухолей: серозные, муцинозные, эндометриоидные, опухоли Бреннера, светлоклеточные и смешанные. Наиболее часто встречаются серозная (50—55%) и муцинозная формы (40—45%), на долю остальных типов ПОЯ приходится 4—5% наблюдений [4, 5]. Характерной особенностью серозных ПОЯ является высокая частота двустороннего поражения яичников, варьирующая от 28 до 66%. Билатеральные муцинозные опухоли наблюдаются не более чем в 10% наблюдений [6, 7].
Экстраовариальные очаги пограничных опухолей на брюшине получили название «имплантов», которые классифицируют на неинвазивные и инвазивные. Чаще выявляют неинвазивные импланты (75%), характеризующиеся торпидным доброкачественным течением. К особенностям этих имплантов следует отнести возможность злокачественной трансформации, способность формировать обширные очаги фиброза в брюшной полости в результате десмоплазии, нередко приводящие к развитию кишечной непроходимости и, как это ни парадоксально, возможность спонтанной регрессии после удаления первичного очага. Инвазивные импланты обнаруживаются в 25% наблюдений и только при серозном варианте ПОЯ. Клинические и морфологические особенности инвазивных имплантов аналогичны таковым при метастазах рака яичников. Учитывая эти обстоятельства, многие патоморфологи предлагают рассматривать серозные пограничные опухоли с инвазивными имплантами как высокодифференцированные серозные аденокарциномы. В целом, перитонеальная диссеминация на момент установки диагноза определяется у 35—38% пациенток с серозными ПОЯ и у 10—15% с муцинозными [8].
Благодаря длительному торпидному течению, ПОЯ в большинстве случаев (60—85%) диагностируют в I стадии процесса. Частота выявления III стадии заболевания составляет 10—35%, при раке яичников — 60—70%. Особенности биологии ПОЯ и преобладание начальных форм заболевания предопределяют хороший прогноз для больных. Если в течение последних десятилетий в результате применения новейших схем лечения удалось приблизить показатели общей 5-летней выживаемости пациенток с раком яичников к 50%, то выживаемость больных с пограничными опухолями остается достаточно стабильной и превышает 90% [7].
Поскольку удельный вес женщин репродуктивного возраста в структуре заболеваемости ПОЯ достаточно высок (более 30%), вопросы сохранения фертильности занимают центральное место в лечении этой категории больных. Благоприятный прогноз, низкая частота рецидивирования и впечатляющие показатели выживаемости, безусловно, создают предпосылки для более широкого применения органосохраняющих и репродуктивных технологий при ПОЯ, чем при раке яичников [9].
Несмотря на высокие показатели выживаемости, поиск новых и оценка существующих прогностических факторов при ПОЯ имеют существенное значение, особенно при планировании органосохраняющего лечения у молодых пациенток.
Как и при раке яичников, при ПОЯ стадия опухолевого процесса является наиболее важным прогностическим фактором. Известно, что у больных с начальными формами болезни рецидивы развиваются в среднем у 5%, при распространенных стадиях — в 25% случаев, а 5-летняя выживаемость при I—II и III—IV стадиях составляет 98 и 82—90% соответственно [7].
Наличие перитонеальных имплантов, особенно инвазивных, является вторым по значимости фактором прогноза. По своему строению и клиническому течению инвазивные импланты очень схожи с метастазами рака яичников и могут служить маркером злокачественной трансформации пограничной опухоли. По данным P. Morice [10], рецидивы при инвазивных имплантах наблюдаются в 2 (45% против 24%) раза чаще, чем при неинвазивных. Десятилетняя выживаемость пациенток с неинвазивными имплантами пограничных опухолей составляет 90—95%, с инвазивными — 60—70%.
В настоящее время в литературе активно обсуждается прогностическая значимость некоторых морфологических особенностей пограничных опухолей. Так, в серозных пограничных опухолях могут быть обнаружены очаги хрупкой микропапиллярной архитектуры (рис. 1, 2,). Результаты проведенных исследований показали, что рост по поверхности яичника и наличие имплантов больше характерны для микрососочковых серозных пограничных опухолей, чем для типичных [11, 12]. Помимо этого, имеются данные об увеличении частоты рецидивов (до 36%) при микрососочковой структуре пограничной опухоли, выявляемой у 12—18% больных [7].
 Рис. 1. Микропапиллярные структуры в ПОЯ. Окраска гематоксилином и эозином, х200.
Рис. 1. Микропапиллярные структуры в ПОЯ. Окраска гематоксилином и эозином, х200.
 Рис. 2. Умеренная ядерная атипия в папиллярных структурах. Окраска гематоксилином и эозином, х400.
Рис. 2. Умеренная ядерная атипия в папиллярных структурах. Окраска гематоксилином и эозином, х400.
Много споров ведется вокруг присутствия в ПОЯ кальцификатов, именуемых псаммомными тельцами. Предпринятые попытки определить их возможное прогностическое значение пока не принесли конкретных результатов. Ряд авторов [13] предполагают, что наличие псаммомных телец в высокодифференцированных аденокарциномах обусловлено хорошим прогнозом, объясняя этот факт тем, что их образование связано с повышенным апоптозом в опухоли. Другие [14] считают, что псаммомные тельца не имеют прогностической значимости.
Некоторые авторы [6, 15] связывают высокую частоту рецидивов с наличием микроинвазии, имеющей место у 10—13% больных, и рассматривают фокусы микроинвазии в качестве мелких очагов инвазивного серозного рака, развивающегося на фоне пограничной опухоли. Считается, что это обстоятельство должно служить поводом к изменению диагноза в пользу рака яичников с применением более агрессивной лечебной тактики.
Определенное прогностическое значение при ПОЯ может иметь ДНК-плоидность опухоли. Так, в работах J. Kaern (1993, 2009) было показано, что при анеуплоидии риск умереть от пограничной опухоли в 19 раз выше, чем при диплоидных образованиях [8].
Убедительных данных о том, что гистологический тип опухоли или вовлечение в опухолевый процесс лимфатических узлов является независимым прогностическим фактором, получено не было. Так, проведенный метаанализ 97 исследований, включавший более 4000 больных с ПОЯ, показал, что 6-летняя выживаемость больных с поражением лимфатических узлов составила 98% [16].
Цель настоящего ретроспективного исследования — оценка влияния на развитие рецидива таких морфологических факторов, как гистологический тип, наличие имплантов, псаммомных телец и микрососочковых структур в пограничной опухоли яичников.
Материалом для исследования служили гистологические препараты пациенток, проходивших лечение или консультированных в МНИОИ им. П.А. Герцена с диагнозом: пограничная опухоль яичников. Исследованы образцы опухолей 101 женщины в возрасте от 18 до 63 лет (средний возраст 32,14 года).
Пациентки были разделены на две группы: 1-я — больные без рецидивов ПОЯ (83 человека — 82,2%); 2-я — больные с рецидивами ПОЯ (18 человек — 17,8%).
Материал фиксировали в 10% забуференном формалине в течение 24 ч, обрабатывали по стандартной методике с использованием ксилола и заливали в парафин. Из блоков изготавливали срезы толщиной 4 мкм, окрашивали гематоксилином и эозином.
Препараты изучали при помощи светового микроскопа Axioskop «OPTON» со стандартным набором оптики. Анализ результатов проводили при помощи пакета программ Statistica 6.0, используя метод процентилей описательной статистики, U-тест Манна—Уитни. Уровень значимости (р) принимали равным 0,05.
Нами было выявлено, что подавляющее большинство (78,2%) исследованных ПОЯ были представлены серозным типом. Муцинозные опухоли имели место в 13,8% случаев, смешанные — в 5%, эндометриоидные — в 3%. Однако при изучении распределения типов ПОЯ в исследуемых группах статистически значимых различий обнаружено не было (р>0,05).
Неинвазивные импланты в группе больных без рецидивов отмечены в 15,7% случаев, а в группе с рецидивами — в 77,8%. При этом были выявлены статистически значимые различия по частоте встречаемости имплантов в исследуемых группах (р<0,05). Случаи с наличием инвазивных имплантов в исследование не включали, так как, по данным некоторых авторов [6, 17], при тщательном исследовании первичного очага обнаруживаются структуры инвазивной высокодифференцированной аденокарциномы.
Было установлено увеличение частоты обнаружения имплантов у пациенток с наличием рецидивов ПОЯ. Возможно, это обусловлено тем, что при наличии перитонеальных имплантов в брюшной полости могут оставаться не выявленные при ревизии микроскопические очаги ПОЯ, которые и являются субстратом развития рецидива.
Известно, что импланты встречаются гораздо чаще при серозном типе ПОЯ, что предопределяет более благоприятное течение других пограничных опухолей и сниженный риск рецидивов. Однако в нашем исследовании не выявлено значимых различий при развитии рецидива в зависимости от гистологического типа опухоли.
Псаммомные тельца обнаружены у 30 (29,7%) из 101 больной. У пациенток с рецидивами они были выявлены в 50% случаев, а у пациенток без рецидивов — в 25,3%. При этом зафиксированы статистически значимые различия между исследуемыми группами (р<0,05).
Микрососочковая архитектура в опухоли отмечена в 8 (7,9%) случаях. При этом все наблюдения были представлены рецидивными ПОЯ. В пограничных опухолях без рецидива микрососочковые структуры не выявляли. Статистические различия между исследуемыми группами оказались значимыми (р<0,05).
Таким образом, хрупкая микрососочковая архитектура чаще ассоциирована с наличием перитонеальных имплантов и с развитием рецидивов ПОЯ, что подтверждается результатами проведенного исследования.
Наличие псаммомных телец в опухолях яичника связывают с усиленным апоптозом в опухолевых клетках. Имеются данные о повышенном содержании коллагена IV типа в псаммомных тельцах, что может послужить причиной активизации металлопротеиназ, задействованных в процессах миграции, и инвазии опухолевых клеток. В результате проведенного исследования мы выявили, что псаммомные тельца чаще встречаются в рецидивных опухолях (50% против 25,3%).
Существенно изменившиеся за последние 20 лет представления о природе ПОЯ, их течении и прогнозе позволили в значительной степени расширить показания к применению органосохраняющих хирургических технологий при этих заболеваниях. Эффективность стандартных органосохраняющих операций при начальных стадиях опухолевого процесса высока как с онкологических позиций, так и в аспекте сохранения репродуктивной функции и качества жизни. Показатели 5-летней выживаемости больных приближаются к 100%. Однако рецидивы после органосохраняющего лечения ПОЯ наблюдаются в 2—4 раза чаще, чем после радикальных операций (10—20% против 5%), при этом наиболее характерная локализация рецидива (75%) — сохраненный яичник. Большинство рецидивов имеют неинвазивный характер, риск злокачественной трансформации опухоли при возникновении рецидива составляет 3—20%, и лечение в этих ситуациях должно соответствовать таковому при раке яичников [8, 9].
Проблема консервативного лечения больных с ПОЯ является одной из наиболее актуальных и дискутируемых в вопросах определения границ и возможностей реализации органосохраняющих технологий и обеспечения их онкологической безопасности для пациенток. Планирование органосохраняющего лечения у больных с ПОЯ в каждом конкретном случае требует от клиницистов и патоморфологов совместной и тщательной оценки прогностических факторов. Особое значение последнее обстоятельство приобретает при выполнении ультраконсервативных операций у пациенток с билатеральным поражением яичников, суть которых состоит в сохранении неизмененной части яичника, пораженного пограничной опухолью, путем выполнения его резекции или цистэктомии. В различных публикациях частота рецидивов после цистэктомий варьирует от 12 до 64% (в среднем 30—35%), что существенно превышает аналогичные показатели после типичных органосохраняющих операций, заключающихся в выполнении аднексэктомии с проведением хирургического стадирования. В качестве основных причин продолженного роста рассматриваются мультицентричность опухолевых зачатков, разрыв капсулы кистозных образований с имплантацией опухолевых клеток на поверхности сохраняемого яичника и наличие элементов опухоли в крае резекции [6]. Результаты проведенного нами исследования свидетельствуют, что микрососочковая структура опухоли и обилие псаммомных телец при морфологическом исследовании могут быть дополнительными факторами риска развития рецидива и должны быть учтены при принятии решения о выполнении органосохраняющей операции, особенно ультраконсервативной.
Мировой опыт консервативных операций при ПОЯ с наличием перитонеальных имплантов в целом невелик, количество проведенных исследований и общее число наблюдений малы. Однако у данных больных авторы отмечают увеличение частоты рецидивов, в том числе в случаях полного удаления имплантов, по сравнению с органосохраняющими операциями у пациенток при I стадии заболевания [18]. Эти данные согласуются с полученными нами результатами в отношении прогностической ценности имплантов и развития рецидива болезни. Тем не менее характер имплантов (инвазивные или неинвазивные) в этих случаях имеет ведущее значение.
В настоящее время проводятся многочисленные исследования, направленные на изучение молекулярно-биологических факторов, влияющих на прогноз ПОЯ. Большое внимание уделяется изучению мутации важных регуляторных генов B-Raf, K-ras, р53, PTEN и исследованию микросателлитной нестабильности. Исследуется экспрессия белка р53, так как сейчас доказана широкая вовлеченность р53 в развитие разных типов опухолей, поскольку выполнение этим белком ряда функций ведет к предотвращению и/или ингибированию опухолевого роста. В то же время прогностическая роль р53 для различных опухолей неравнозначна [19]. Так же изучается прогностическая значимость экспрессии белков р21 и р27 (ингибиторы циклинзависимых киназ), являющихся важнейшими медиаторами ингибирующего эффекта р53 на клеточный цикл. В качестве прогностических критериев проводится исследование экспрессии белков, участвующих в регуляции пролиферации (Ki-67, циклины и др.) и апоптоза (bcl-2, bcl-x, bak, bax, сурвивин). Важными прогностическими факторами для ПОЯ, возможно, могут быть некоторые металлопротеиназы (протеазы, участвующие в ремоделировании внеклеточного матрикса и определяющие инвазивный и метастатический потенциал неопластических клеток) и их тканевые ингибиторы. Необходимо изучение мутаций гена β-катенина (CTNNB1), играющего ключевую роль в особом Wnt-пути сигнальной трансдукции, а также ядерной экспрессии белка β-катенина, связанного с биологической агрессивностью различных опухолей [20]. Таким образом, требуется дальнейшее исследование молекулярно-биологических характеристик пограничных опухолей на большом количестве материала с тщательным сопоставлением полученных результатов и клинических данных. Возможно, полученные результаты позволят выделить совокупность факторов, определяющих биологическую агрессивность этих опухолей, и окажут существенную помощь клиницистам в принятии решений.
Участие авторов:
Концепция и дизайн исследования: Ю.Ю.А., Л.Э.З.
Сбор и обработка материала: А.С.Ш.
Написание текста: И.И.В., А.С.Ш.
Статистическая обработка материала: И.И.В.
Редактирование: Е.Г.Н., Г. А.Ф.
Источник